题目内容
16.一定条件下,达到平衡状态时的可逆反应2A(g)?2B(g)+C(g)(正反应为吸热反应),要使B的物质的量增大,而正反应速率降低,可采取的措施是( )①升高温度②降低温度③增大压强④减小压强⑤增大B的浓度⑥减小C的浓度.
| A. | ①③⑥ | B. | ①④⑥ | C. | ②③⑤ | D. | ④⑥ |
分析 达平衡时,要使v正降低,可采取降低温度、减小压强或减小浓度的措施,且使B的物质的量增大,应使平衡向正反应方向移动,结合平衡移动原理分析解答.
解答 解:①升高温度反应速率增大,故错误;
②降低温度,平衡逆向移动,B的物质的量减小,故错误;
③增大压强,反应速率增大,故错误;
④减小体系的压强,正反应速率降低,正反应方向为体积增大的反应,平衡向正反应方向移动,B的物质的量增大,故正确;
⑤增大B的浓度,正逆反应速率都增大,故错误;
⑥减小C的浓度,平衡正向移动,B的量增大,反应速率减小,故正确.
故选D.
点评 本题考查外界条件对化学平衡的影响,为高频考点,难度不大,本题注意根据反应方程式的特征判断平衡移动的方向.

练习册系列答案
相关题目
6.下列实验操作中错误的是( )
| A. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,萃取剂只要是有机溶剂即可 |
7.某混合溶液中含SO42-0.25mol/L,含Cl-0.5mol/L,NO3-0.25mol/L,含Na+0.25mol/L,其余为H+,则H+的物质的量浓度为( )
| A. | 5mol/L | B. | 2.5mol/L | C. | 1mol/L | D. | 0.1mol/L |
4.进入秋冬季节后,雾霾这种环境污染问题逐渐凸显.从物质分类来看雾霾属于胶体,它区别于溶液等其它分散系的本质特征是( )
| A. | 产生丁达尔现象 | B. | 胶体是混合物 | ||
| C. | 分散质粒子直径在1nm~100nm之间 | D. | 胶体的分散剂为气体 |
11.在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用( )
| A. | NaCl | B. | HC1 | C. | CuSO4 | D. | Na2SO4 |
5.下列说法正确的是( )
| A. | 明矾用于净水与K+、Al3+的水解有关 | |
| B. | 配制FeCl3溶液时,为了抑制Fe3+的水解,常加入少量稀硫酸 | |
| C. | 常常用排饱和食盐水的方法收集氯气,可以避免氯气溶于水而损失 | |
| D. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 |
 某学生利用如图实验装置探究盐桥式原电池的工作原理
某学生利用如图实验装置探究盐桥式原电池的工作原理 .
.
 (R、R’代表烃基)
(R、R’代表烃基) .
. .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH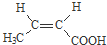 .
. .
.