题目内容
(1)已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图1所示.
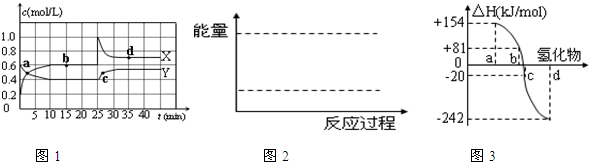
①图1中a、b、c、d四个点中,表示化学反应处于平衡状态的点是 .
②前10min内用NO2表示的化学反应速率v(NO2)= mol?L-1?min-1.反应在第一个平衡点的平衡常数K(1)= (可用分数表示).反应在第二个平衡点的平衡常数K(2)与第一个平衡点的平衡常数K(1)的关系:K(2) K(1)(填“>”、“=”或“<”).
③请在如图2坐标中画出1mol N2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式.
(2)如图3中a、b、c、d分别代表氧族元素(ⅥA族):Te(碲)、Se(硒)、S、O氢化物的反应热的数据示意图.试回答下列问题:
①写出硒化氢发生分解反应的热化学反应方程式: .

①图1中a、b、c、d四个点中,表示化学反应处于平衡状态的点是
②前10min内用NO2表示的化学反应速率v(NO2)=
③请在如图2坐标中画出1mol N2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式.
(2)如图3中a、b、c、d分别代表氧族元素(ⅥA族):Te(碲)、Se(硒)、S、O氢化物的反应热的数据示意图.试回答下列问题:
①写出硒化氢发生分解反应的热化学反应方程式:
考点:物质的量或浓度随时间的变化曲线,反应热和焓变,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题
分析:(1)由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线,
①根据图象及物质的浓度不发生变化时表示化学反应处于平衡状态;
②根据v=
求得速率,根据平衡常数的定义和图中的平衡浓度可求得平衡常数,根据影响平衡常数的因素可比较出K(2)、K(1)的大小;
③根据反应中的能量变化可以画出相关的图;
(2)①根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.
①根据图象及物质的浓度不发生变化时表示化学反应处于平衡状态;
②根据v=
| △c |
| △t |
③根据反应中的能量变化可以画出相关的图;
(2)①根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.
解答:
解:(1)由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;
①由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,
故答案为:bd;
②由图可知,前10min内用NO2的物质的量浓度变化为:0.6mol/L-0.2mol/L=0.4mol/L,故化学反应速率v(NO2)=
=0.04mol?L-1?min-1;
由图可知,在第一个平衡点c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L,故平衡常数K=
=
;
由于平衡常数只与温度有关,所以当温度不变时,平衡常数不变,
故答案为:0.04;
;=;
③1mol N2O4通入2L的密闭容器中,四氧化二氮转化成二氧化氮的反应为吸热反应,二氧化氮能量大于四氧化二氮,反应发生过程中的能量变化示意图为: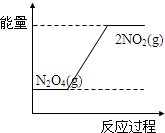 ,故答案为:
,故答案为: ;
;
(2)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O,则b为硒化氢的生成热数据,硒化氢分解吸热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,
故答案为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
①由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,
故答案为:bd;
②由图可知,前10min内用NO2的物质的量浓度变化为:0.6mol/L-0.2mol/L=0.4mol/L,故化学反应速率v(NO2)=
| 0.4mol/L |
| 10min |
由图可知,在第一个平衡点c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L,故平衡常数K=
| 0.4 |
| 0.62 |
| 10 |
| 9 |
由于平衡常数只与温度有关,所以当温度不变时,平衡常数不变,
故答案为:0.04;
| 10 |
| 9 |
③1mol N2O4通入2L的密闭容器中,四氧化二氮转化成二氧化氮的反应为吸热反应,二氧化氮能量大于四氧化二氮,反应发生过程中的能量变化示意图为:
 ,故答案为:
,故答案为: ;
;(2)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O,则b为硒化氢的生成热数据,硒化氢分解吸热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,
故答案为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
点评:本题考查了平衡状态的判断、反应速率的计算、影响平衡常数的因素、化学反应与能量变化等知识,题目难度中等,注意掌握化学平衡的影响因素、化学平衡常数的计算,(2)中从图象判断各种氢化物的种类为解答该题的关键.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
除去粗盐中的Ca2+、Mg2+、SO42-,可将粗盐溶于水后进行如下操作:①过滤,②加过量的NaOH溶液,③加适量的盐酸,④加过量的Na2CO3溶液,⑤加过量的BaCl2溶液,⑥蒸发结晶,其中操作顺序正确的是( )
| A、①②③④⑤⑥ |
| B、②⑤④①③⑥ |
| C、①②④⑤③⑥ |
| D、④②③①⑤⑥ |
某有机物的结构为HO-CH2-CH=CHCH2-COOH,该有机物不可能发生的化学反应是( )
| A、水解反应 | B、酯化反应 |
| C、加成反应 | D、氧化反应 |
某火锅城将正规渠道获得的罂粟壳放入火锅中让顾客食用,下列说法不正确的( )
| A、火锅城的行为违法 |
| B、火锅城欺骗他人吸食毒品 |
| C、吗啡、病毒、海洛因都是毒品 |
| D、罂粟壳是人工合成的毒品 |
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有: