题目内容
19.有X、Y、Z三种元素,已知①X、Y、Z的单质在常温下均为气体;②X单质可在Z单质中燃烧,生成XZ,火焰为苍白色;③2molX2分子可与1molY2分子化合生成2molX2Y分子,X2Y在常温下为液体;④Z单质溶于X2Y中,所得溶液具有漂白作用;⑤细铁丝能在Z2中剧烈燃烧,且产生棕褐色烟.推断:(1)X、Y、Z三种元素的名称X氢Y氧,Z氯
(2)写出的④化学反应方程式为:Cl2+H2O?HCl+HClO.
⑤的化学反应方程式为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
分析 有X、Y、Z三种元素,它们的单质在常温、常压下皆为气体.X单质可在Z单质中燃烧,生成XZ,火焰为苍白色,其火焰为苍白色,细铁丝能在Z2中剧烈燃烧,且产生棕褐色烟,则X单质为H2,Z单质为Cl2,YZ为HCl;2molX2分子可与1molY2分子化合生成2molX2Y分子,X2Y在常温下为液体,说明Y单质为O2,X2Y为H2O,Cl2溶于H2O中,反应生成HCl和HClO,HClO具有漂白作用,以此解答该题.
解答 解:有X、Y、Z三种元素,它们的单质在常温、常压下皆为气体.X单质可在Z单质中燃烧,生成XZ,火焰为苍白色,其火焰为苍白色,细铁丝能在Z2中剧烈燃烧,且产生棕褐色烟,则X单质为H2,Z单质为Cl2,YZ为HCl;2molX2分子可与1molY2分子化合生成2molX2Y分子,X2Y在常温下为液体,说明Y单质为O2,X2Y为H2O,Cl2溶于H2O中,反应生成HCl和HClO,HClO具有漂白作用.
(1)由上述分析可知,X为氢元素、Y为氧气、Z为氯元素,故答案为:氢;氧;氯;
(2)④化学反应方程式为:Cl2+H2O?HCl+HClO,
⑤的化学反应方程式为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:Cl2+H2O?HCl+HClO;2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
点评 本题考查无机物的推断,侧重于学生的分析能力的考查,根据物质的颜色、状态、反应现象等为推断的突破口,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
14.X、Y、Z、W是短周期元素,原子序数依次递增.X与Z位于同一主族,Y 元素的+3价阳离子的核外电子排布与氖原子相同,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
| A. | 气态氢化物的稳定性:X<Z<W | |
| B. | X、Z、W氧化物对应水化物酸性的强弱顺序为X<Z<W | |
| C. | Y的阳离子半径比W的阴离子半径小 | |
| D. | 室温下,含Y元素的盐形成的水溶液其pH<7 |
4.用NA表示阿伏加德罗常数,下列有关说法中一定正确的是( )
| A. | 2.3Na与O2完全反应生成3.6g产物时失去电子数为0.1NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 | |
| C. | 标准状况下,11.2LSO3中所含原子数为2NA | |
| D. | 5.6g铁粉与稀硝酸反应失去的电子数一定为0.2NA |
11.下列说法正确的是( )
| A. | 乙醇既可以发生催化氧化反应,又可以发生酯化反应 | |
| B. | 用溴水可以鉴别乙醇、乙酸和苯 | |
| C. | 糖类、油脂、蛋白质三类物质都只含有C、H、O三种元素 | |
| D. | C5H10O属于醛类的同分异构体为六种 |
8. 某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是
某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是
( )
 某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是
某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是( )
| A | B | C | D | |
| a电极 | 阳极 | 阴极 | 阳极 | 阴极 |
| d电极 | 正极 | 正极 | 负极 | 负极 |
| Q离子 | 阳离子 | 阳离子 | 阴离子 | 阴离子 |
| A. | A | B. | B | C. | C | D. | D |
9.从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
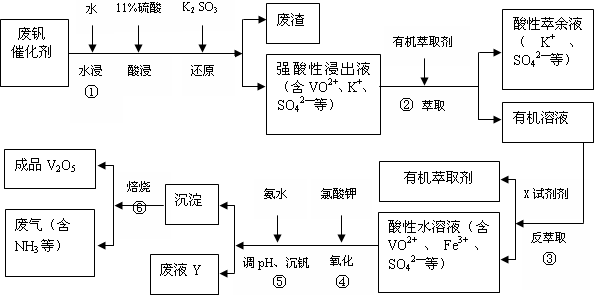
(1)①中废渣的主要成分是SiO2.
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2n HA(有机层) 2RAn(有机层)+n H2SO4(水层).
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移,提高钒的萃取率;
③中反萃取时加入的X试剂是硫酸.
(3)完成④中反应的离子方程式:
1ClO3-+6VO2++6H+═6VO3++1(Cl-)+3(H2O)
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如表
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为1.7;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3.(已知:25℃时,Ksp(Fe(OH)3)=2.6×10-39.)
(5)写出废液Y中除H+之外的两种阳离子:Fe3+、VO3+、NH4+、K+(任写两种即可).
(6)生产时,将②中的酸性萃余液循环用于①中的水浸.在整个工艺过程中,可以循环利用的物质还有有机萃取剂、氨水(或氨气).
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所,a、b均为惰性电极),已知:V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色.当充电时,右槽溶液颜色由绿色变为紫色.则:
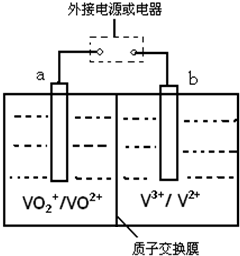
①全矾液流电池的工作原理为:
VO2++V2++2H+ $?_{()电}^{()电}$ VO2++H2O+V3+
(请在可逆符号两侧的括号中填“充”、“放”)
②放电过程中,a极的反应式为VO2++2H++e-=VO2++H2O;当有1.0mol电子时共有1.0mol H+从右槽迁移进左槽(填“左”、“右”)

(1)①中废渣的主要成分是SiO2.
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2n HA(有机层) 2RAn(有机层)+n H2SO4(水层).
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移,提高钒的萃取率;
③中反萃取时加入的X试剂是硫酸.
(3)完成④中反应的离子方程式:
1ClO3-+6VO2++6H+═6VO3++1(Cl-)+3(H2O)
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如表
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(5)写出废液Y中除H+之外的两种阳离子:Fe3+、VO3+、NH4+、K+(任写两种即可).
(6)生产时,将②中的酸性萃余液循环用于①中的水浸.在整个工艺过程中,可以循环利用的物质还有有机萃取剂、氨水(或氨气).
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所,a、b均为惰性电极),已知:V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色.当充电时,右槽溶液颜色由绿色变为紫色.则:

①全矾液流电池的工作原理为:
VO2++V2++2H+ $?_{()电}^{()电}$ VO2++H2O+V3+
(请在可逆符号两侧的括号中填“充”、“放”)
②放电过程中,a极的反应式为VO2++2H++e-=VO2++H2O;当有1.0mol电子时共有1.0mol H+从右槽迁移进左槽(填“左”、“右”)
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1. .
.