题目内容
如图各装置不能达到实验目的是( )
A、 如图装置可用于从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 |
B、 如图装置可用于干燥、收集氨气,并吸收多余的氨气 |
C、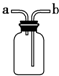 如图装置可用于排空气法收集NO2气体 |
D、 如图装置可用于证明Cl2易与NaOH溶液反应 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.胶体能透过滤纸;
B.氨气密度小于空气密度,可以采用向下排空气法收集,倒置漏斗能防止倒吸;
C.NO2气体密度比空气大;
D.氯气与NaOH溶液反应,可形成喷泉.
B.氨气密度小于空气密度,可以采用向下排空气法收集,倒置漏斗能防止倒吸;
C.NO2气体密度比空气大;
D.氯气与NaOH溶液反应,可形成喷泉.
解答:
解:A.胶体能透过滤纸,不能利用图中装置得到胶体,可利用渗析法进行胶体的提纯,故A错误;
B.碱石灰的主要成分是氧化钙和固体氢氧化钠,碱石灰呈碱性,所以能干燥碱性气体氨气,氨气的密度小于空气密度且和氧气不反应,所以可以用向下排空气法收集氨气,氨气极易溶于水,倒置的漏斗有缓冲作用,所以可以用倒置的漏斗吸收氨气,故B正确;
C.NO2气体密度比空气大,可用向上排空气法收集,故C正确;
D.氯气与NaOH溶液反应,导致圆底烧瓶内压强减小,可形成喷泉,故D正确.
故选A.
B.碱石灰的主要成分是氧化钙和固体氢氧化钠,碱石灰呈碱性,所以能干燥碱性气体氨气,氨气的密度小于空气密度且和氧气不反应,所以可以用向下排空气法收集氨气,氨气极易溶于水,倒置的漏斗有缓冲作用,所以可以用倒置的漏斗吸收氨气,故B正确;
C.NO2气体密度比空气大,可用向上排空气法收集,故C正确;
D.氯气与NaOH溶液反应,导致圆底烧瓶内压强减小,可形成喷泉,故D正确.
故选A.
点评:本题考查物质的分离提纯,气体的收集、干燥等知识点,掌握相关物质的化学性质是解答的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
对于反应X(g)+Y(g)═2Z(g)△H<0,下列有关说法错误的是( )
| A、反应达到平衡后,加入催化剂,Z的产率不变,反应速率增大 |
| B、反应达到平衡后,若降低温度,Y的转化率增大 |
| C、若反应在固定的密闭容器中进行,当压强不再变化时,反应达到平衡状态 |
| D、反应达到平衡后,增大c(X),平衡右移,K值不变 |
下列关于化学电源的叙述错误的是( )
| A、普通锌锰干电池中碳棒为正极 |
| B、铅蓄电池中覆盖着PbO2的电极板是负极板 |
| C、氢氧燃料电池的正极是通入氧气的那一极 |
| D、碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高 |
下列离子组能大量共存的是( )
| A、Ag+ Cl- Br- K+ |
| B、Fe3+ H+SiO32- I- |
| C、NH4+Na+ OH- HCO3- |
| D、Cu2+ SO42- NO3- Al3+ |
下列两种物质不属于同分异构体的是( )
| A、淀粉 纤维素 |
| B、蔗糖 麦芽糖 |
| C、正丁烷 异丁烷 |
| D、果糖 葡萄糖 |
用NA表示阿佛加德罗常数,下列叙述中正确的是( )
| A、常温常压下,22.4 L的氧气含氧原子数为2NA |
| B、5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| C、常温下,23g NO2含有NA个氧原子 |
| D、足量铜与1L 18mol?L-1浓硫酸反应可以得到SO2的分子总数为9NA |
NA为阿伏加德罗常数,下列说法中正确的是( )
| A、22.4 L Cl2中含有NA个Cl2分子 |
| B、标准状况下,22.4L CCl4中含有的CCl4分子数为NA |
| C、1.0 L 浓度为18mol?L-1H2SO4溶液与足量的铜片加热条件下反应,被还原的H2SO4的分子数为9NA |
| D、一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去的电子数为0.1NA |

 Ⅰ.今有H2、Cl2混合气100mL(标况),其中一种气体的体积为45mL.光照使两种气体发生反应后恢复到标况,气体体积为
Ⅰ.今有H2、Cl2混合气100mL(标况),其中一种气体的体积为45mL.光照使两种气体发生反应后恢复到标况,气体体积为