题目内容
12.下列化学用语正确的是( )| A. | 乙醇分子的结构式: | B. | 氯原子的结构示意 | ||
| C. | 过氧化氢分子的电子式: | D. | 乙烯的最简式:C2H4 |
分析 A.乙醇是共价化合物,分子中含羟基官能团,原子间形成一个共价键;
B.氯原子核外17个电子最外层7个电子;
C.过氧化氢是共价化合物,氧原子和氢原子间形成极性共价键,氧原子和氧原子间形成非极性共价键;
D.最简式是指分子式中原子个数最简比时的式子.
解答 解:A.乙醇分子含一个羟基官能团,碳碳原子中间形成单键,分子的结构式: ,故A正确;
,故A正确;
B.氯原子的核外电子数为17,氯原子的原子结构示意图为: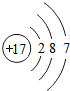 ,故B错误;
,故B错误;
C.过氧化氢是共价化合物,分子中形成的化学键是:氧原子和氢原子间形成极性共价键,氧原子和氧原子间形成非极性共价键,过氧化氢为共价化合物,电子式为 ,故C错误;
,故C错误;
D.乙烯分子式C2H4,最简式CH2,故D错误;
故选A.
点评 本题考查了原子结构示意图、电子式、结构简式等知识,题目难度中等,注意掌握离子化合物与共价化合物的电子式区别,明确电子式、分子式、结构简式、结构式的正确表示方法.

练习册系列答案
相关题目
10.下列有关糖类、油脂和蛋白质的说法中正确的是( )
| A. | 油脂是热值最高的营养物质,也是一种重要的工业原料 | |
| B. | 葡萄糖、蔗糖、淀粉和纤维素都属于糖类,都属于高分子化合物 | |
| C. | 氨基乙酸分别与酸和碱反应都生成盐和水 | |
| D. | 往蛋白质溶液中加入浓的Na2SO4溶液,有沉淀析出,加水后沉淀又溶解,但已失去生理活性 |
3.下列各组物质中,化学键的类型完全相同的是( )
| A. | H2S、MgCl2 | B. | NH3、CO2 | C. | CaCl2、NaOH | D. | H2O2、Na2O2 |
20.酚酞是一种常用的酸碱指示剂,其结构简式如图所示,酚酞属于( )


| A. | 氧化物 | B. | 碱 | C. | 有机物 | D. | 无机物 |
7.下列有机化学反应方程式的书写及反应类型判断都正确的是( )
| A. | CH4+Cl2$\stackrel{光}{→}$CH2Cl2+H2 取代反应 | |
| B. | CH2=CH2+Br2→CH3CHBr2 加成反应 | |
| C. | 2 CH3CHO+O2$\stackrel{催化剂}{→}$2CH3COOH 加成反应 | |
| D. | CH3COOC2H5+H2O$→_{△}^{浓硫酸}$CH3COOH+C2H5OH 取代反应 |
17.下列反应的离子方程式书写正确的是( )
| A. | 锌粒与稀硝酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 稀醋酸加入到氢氧化钡溶液中:H++OH-=H2O | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 钠与水反应:Na+2H2O=Na++2 OH-+H2↑ |
4.化学与人类生产、生活、科研密切相关,下列有关说法正确的是( )
| A. | 工业从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 | |
| B. | 向牛奶中加入果汁会产生沉淀,这是因为发生了酸碱中和反应 | |
| C. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| D. | 糖类、蛋白质和油脂都属于营养物质,都能发生水解反应 |
1. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于表:
①可以判断该分解反应已经达到平衡的是BC.(填编号)
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8mol3/L3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
计算25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总液度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8mol3/L3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
计算25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率0.05mol/(L•min).
2.下列以高粱为主要原料的酿醋工艺中,利用醋酸溶解性的是( )
| A. |  蒸拌原料 蒸拌原料 | B. |  淀粉发酵 淀粉发酵 | C. |  用水浸淋 | D. |  放置陈酿 放置陈酿 |