题目内容
9.有一未知浓度的盐酸溶液25mol,在加入0.5mol/LAgNO3溶液25ml后,再加入0.1mol/L NaOH溶液,当加入25mL时恰好完全中和,则此盐酸的物质的量浓度为( )| A. | 0.2mol/L | B. | 0.5 mol/L | C. | 0.1 mol/L | D. | 0.25 mol/L |
分析 盐酸与硝酸银反应中,盐酸中的氢离子不参加反应,氯化氢在溶液中电离的氢离子与HCl的物质的量相等,根据NaOH+HCl=NaCl+H2O可知,氢氧化钠的物质的量就等于HCl的物质的量,据此计算出HCl的物质的量,再根据c=$\frac{n}{V}$计算出盐酸的物质的量浓度.
解答 解:盐酸中的氢离子不与硝酸银反应,即硝酸银不消耗氢离子,可以根据NaOH的物质的量计算出HCl的物质的量,25mL0.1mol/L的NaOH溶液中含有氢氧化钠的物质的量为:0.1mol/L×0.025L=0.0025mol,
根据反应方程式NaOH+HCl=NaCl+H2O可知,n(HCl)=n(NaOH)=0.0025mol,
则此盐酸的物质的量浓度为:c(HCl)=$\frac{0.0025mol}{0.025L}$=0.1mol/L,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,注意 掌握根据化学反应方程式进行化学计算的方法,明确有关物质的量的浓度的计算方法,明确离子之间的反应实质为解答本题的关键.

练习册系列答案
相关题目
19.据报道,某些花岗岩会产生氡(${\;}_{86}^{222}$Rn),这是一种放射性很强的原子,会对人体产生伤害,因此,家庭装修时应尽量避免使用天然产的花岗岩材料.已知氡是一种稀有气体元素,下列叙述正确的是( )
| A. | 该原子最外层有8个电子 | |
| B. | 1mol气体氡的质量大约是444g | |
| C. | 该原子中子数是86 | |
| D. | 该原子与同周期ⅠA.ⅡA族阳离子具有相同的核外电子层结构 |
20.下列各类物质中,固态时只能形成离子晶体的是( )
| A. | 非金属氧化物 | B. | 非金属单质 | C. | 强酸 | D. | 强碱 |
4.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 32g氧气所含原子数目为2NA | |
| B. | 在常温常压下,11.2L氯气含有的分子数为0.5NA | |
| C. | 氯化氢的摩尔质量为36.5g | |
| D. | 在标准状况下,22.4L水的物质的量是1mol |
14.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
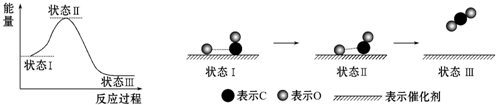
下列说法中正确的是( )

下列说法中正确的是( )
| A. | CO和O生成CO2是吸热反应 | B. | 状态Ⅰ→状态Ⅲ表示CO和O反应的过程 | ||
| C. | CO和O生成了具有非极性键的CO2 | D. | 在该过程中,CO断键形成C和O |
1.某种饱和脂肪酸的单甘油酷22.25g,完成皂化反应时需3.00g氢氧化钠,则这种高级脂肪酸中的碳原子数接近的数值是( )
| A. | 15 | B. | 16 | C. | 17 | D. | 18 |
13.A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子序数之和等于B原子的原子序数.B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素的名称:氮、硫、氟.
(2)B位于元素周期表中第三周期ⅥA族.
(3)C的单质与H2反应的化学方程式为:H2+F2=2HF.
(4)写出A的最高价氧化物所对应的水化物与NaOH溶液反应的化学方程式为:NaOH+HNO3=H2O+NaNO3.
| A | C | |
| B |
(2)B位于元素周期表中第三周期ⅥA族.
(3)C的单质与H2反应的化学方程式为:H2+F2=2HF.
(4)写出A的最高价氧化物所对应的水化物与NaOH溶液反应的化学方程式为:NaOH+HNO3=H2O+NaNO3.
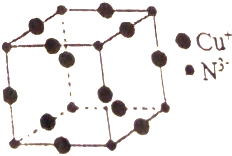 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用.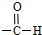 )碳原子的杂化方式为sp2;乙醇的沸点明显高于乙醛,其主要原因为乙醇分子间存在氢键.
)碳原子的杂化方式为sp2;乙醇的沸点明显高于乙醛,其主要原因为乙醇分子间存在氢键. .
.