题目内容
为了证明稀硝酸与铜反应的气体产物是NO,某同学设计了如下实验装置和实验方案.
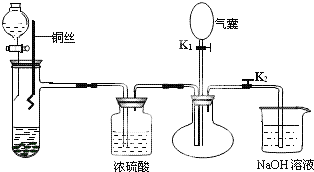
实验步骤:
(1)关闭K1,打开K2,向试管中加石灰石,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是 ,反应化学方程式是 .
(2)将将铜丝插入稀硝酸中,微热大试管.该步反应离子方程式是 .
(3)充分反应后,打开开关K1,通过气囊鼓入空气,可以观察到烧瓶中 ,证明稀硝酸与铜反应的气体产物是NO.
(4)NaOH溶液的作用 .

实验步骤:
(1)关闭K1,打开K2,向试管中加石灰石,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是
(2)将将铜丝插入稀硝酸中,微热大试管.该步反应离子方程式是
(3)充分反应后,打开开关K1,通过气囊鼓入空气,可以观察到烧瓶中
(4)NaOH溶液的作用
考点:实验装置综合
专题:实验题
分析:(1)NO能与空气中的氧气反应,所以先用二氧化碳把装置中的空气排尽;硝酸与碳酸钙反应生成硝酸钙和二氧化碳、水;
(2)Cu与稀硝酸反应生成NO,根据化学方程式写离子方程式;
(3)NO与氧气反应生成红棕色的二氧化氮;
(4)二氧化氮是有毒气体,会污染环境.
(2)Cu与稀硝酸反应生成NO,根据化学方程式写离子方程式;
(3)NO与氧气反应生成红棕色的二氧化氮;
(4)二氧化氮是有毒气体,会污染环境.
解答:
解:(1)NO能与空气中的氧气反应,所以先用二氧化碳把装置中的空气排尽,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是与硝酸生成CO2,将装置中的空气排尽;硝酸与碳酸钙反应生成硝酸钙和二氧化碳、水,反应的化学方程式为:2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑;
故答案为:与硝酸生成CO2,将装置中的空气排尽;2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑;
(2)将将铜丝插入稀硝酸中,微热大试管,Cu与稀硝酸反应生成NO、硝酸铜和水,则反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)打开开关K1,通过气囊鼓入空气,圆底烧瓶中NO与氧气反应生成红棕色的二氧化氮,可以观察到烧瓶中无色气体变为红棕色,
故答案为:无色气体变为红棕色;
(4)二氧化氮是有毒气体,会污染环境,所以要用NaOH溶液吸收二氧化氮,防止污染环境,故答案为:尾气处理,避免污染环境.
故答案为:与硝酸生成CO2,将装置中的空气排尽;2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑;
(2)将将铜丝插入稀硝酸中,微热大试管,Cu与稀硝酸反应生成NO、硝酸铜和水,则反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)打开开关K1,通过气囊鼓入空气,圆底烧瓶中NO与氧气反应生成红棕色的二氧化氮,可以观察到烧瓶中无色气体变为红棕色,
故答案为:无色气体变为红棕色;
(4)二氧化氮是有毒气体,会污染环境,所以要用NaOH溶液吸收二氧化氮,防止污染环境,故答案为:尾气处理,避免污染环境.
点评:本题考查了NO的制备、NO性质的实验方案设计,题目难度中等,侧重于实验装置的综合考查,明确硝酸和NO的性质即可解答.

练习册系列答案
相关题目
常温下,将Na2CO3和NaHCO3两种盐按物质的量比1:1混合后溶于水配成稀溶液,下列有关该混合溶液说法正确的是( )
| A、溶液中c(CO32-):c(HCO3-)<1:1 |
| B、溶液中c(OH-)+(CO32-)=c(H+)+c(HCO3-)+c(H2CO3) |
| C、向混合液中滴加少量稀盐酸或NaOH溶液,HCO3-的物质的量均会减少 |
| D、将混合液蒸干,水解加剧,最终得NaOH固体 |
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pCO32-=-lg c(CO32-).下列说法不正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pCO32-=-lg c(CO32-).下列说法不正确的是( )| A、MgCO3、CaCO3、MnCO3 的Ksp依次减小 |
| B、a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32-) |
| C、b 点可表示的CaCO3不饱和溶液,且c(Ca2+)<c(CO32-) |
| D、c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32-) |
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变,且用惰性电极,下列说法不正确的是( )
| A、当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 |
| B、电池的正极反应式为:O2+2H2O+4e-═4OH- |
| C、电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D、燃料电池中c(KOH)不变 |
在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、混合气体的分子数目 |
| D、混合气体的总物质的量 |