题目内容
3.将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示: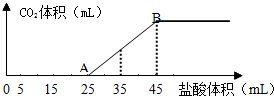
(1)写出OA段所发生反应的离子方程式H++OH-═H2O、CO32-+H+═HCO3-.
(2)当加入45mL盐酸时,产生CO2的体积为448mL(标准状况).
分析 (1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,则OA段先发生酸碱中和,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠.
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体.
解答 解:(1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,则OA段0~5mL先发生酸碱中和,其离子反应方程式为H++OH-═H2O,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠,其离子反应方程式为CO32-+H+═HCO3-,
故答案为:H++OH-═H2O;CO32-+H+═HCO3-;
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,
设生成二氧化碳的物质的量为n,生成气体时消耗的酸的物质的量为(45-25)×10-3L×1mol•L-1=0.02mol,则
HCO3-+H+═CO2↑+H2O
1 1
0.02mol n
则:$\frac{1}{1}=\frac{0.02mol}{n}$,解得:n=0.02mol,标准状况下其体积为:0.02mol×22.4L/mol=0.228L=448mL,
故答案为:448.
点评 本题考查学生利用图象和发生的离子反应来分析解答问题,题目难度中等,明确反应的先后顺序及图象中每段图象对应的化学反应是解答本题的关键,试题培养了学生的化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.常温下,下列有关叙述错误的是( )
| A. | 滴有酚酞的氨水中加入少量NH4Cl固体,溶液颜色变浅 | |
| B. | 等浓度的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 向pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则体积V(HA)≤V(NaOH) | |
| D. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 |
11.相对原子质量为X的原子的实际质量为( )
| A. | X | B. | Xg | C. | $\frac{X}{{N}_{A}}$g | D. | $\frac{1}{{N}_{A}}$g |
18.下列化学用语中,不正确的是( )
| A. | CO2的电子式: | B. | 乙炔分子的结构式H-C≡C-H | ||
| C. | H2O分子的比例模型  | D. | Clˉ离子的结构示意图: |
8.下列叙述中不正确的是( )
| A. | 向沸水中滴加FeCl3饱和溶液可以制备Fe(OH)3胶体 | |
| B. | 用纯碱溶液清洗油污时,加热可以增强其去污能力 | |
| C. | 向纯水中加入稀硫酸或降温都能使水的离子积减小 | |
| D. | 锅炉中沉积的CaSO4可用足量Na2CO3溶液浸泡后,再用稀盐酸溶解掉不溶物 |
12.在高压下将CO2可以转化为具有类似SiO2结构的原子晶体.下列关于CO2的原子晶体说法正确的是( )
| A. | CO2的原子晶体和分子晶体互为同素异形体 | |
| B. | CO2的原子晶体和CO2的分子晶体具有相同的物理性质 | |
| C. | 对于CO2原子晶体,“CO2”是化学式,不是分子式 | |
| D. | CO2原子晶体在一定条件下转化为分子晶体的变化是物理变化 |
10.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 加热NaCl使之融化 | D. | 氢气在氯气中燃烧 |

 .
.