题目内容
14.已知一定条件下:A2B5(g)?A2B3(g)+B2(g);A2B3(g)?A2B(g)+B2(g)在容积为2L的密闭容器中,将4molA2B3加热至t℃达平衡后,A2B3浓度为0.5mol/L,A2B5浓度为0.7mol/L,则t℃时,B2平衡浓度是( )| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.9mol/L | D. | 1.5mol/L |
分析 应用原子守恒法,初始时存在的物质是A2B3,A的物质的量是4mol×2=8mol,B的物质的量是4mol×3=12mol;
反应平衡后,存在的物质是A2B5,A2B3,A2B和B2,
A2B5(g)?A2B3(g)+B2(g),
A2B3(g)?A2B(g)+B2(g),
令B2(g)平衡浓度为xmol/L,A2B(g)平衡浓度为ymol/L,根据它们的浓度和容器容积可以分别算出它们中含A和B元素的物质的量,分别计算出A、B的物质的量,列方程组解答.
解答 解:初始时存在的物质是A2B3,A的物质的量是4mol×2=8mol,B的物质的量是4mol×3=12mol;
反应平衡后,存在的物质是A2B5,A2B3,A2B和B2,
A2B5(g)?A2B3(g)+B2(g),
A2B3(g)?A2B(g)+B2(g),
根据它们的浓度和容器容积可以分别算出它们中含A和B元素的物质的量,
假设B2浓度为x mol/L,第二个反应的A2B的浓度为y mol/L,如下所示:
物质:A2B5 A2B3 A2B B2
浓度:0.7mol/L 0.5mol/L ymol/L xmol/L
物质的量:1.4mol 1 mol 2y mol 2xmol
A物质的量:2.8mol 2 mol 4y mol 0mol
B物质的量:7mol 3 mol 2y mol 4xmol
根据A原子物质的量反应前后相等(即A原子总数不变,原子守恒),得
2.8+2+4y+0=8mol
根据B原子物质的量反应前后相等(即B原子总数不变,原子守恒),得
7+3+2y+4x=12mol
解方程组得:x=0.1 mol/L,y=0.8mol/L
故选A.
点评 本题考查化学平衡的有关计算,利用原子守恒法解题方便,注意物质的存在形式分析,题目难度较大.

| A. | 8.4g | B. | 4.2g | C. | 3.6g | D. | 无法确定 |
| A. | 观察(得出Br2物理性质)→实验、观察→预测(推测Br2化学性质)→解释并得出结论 | |
| B. | 预测(推测Br2化学性质)→观察(得出Br2物理性质)→解释并得出结论→实验、观察 | |
| C. | 观察(得出Br2物理性质)→预测(推测Br2化学性质)→实验、观察→解释并得出结论 | |
| D. | 实验、观察→预测(推测Br2化学性质)→观察(得出Br2物理性质)→解释并得出结论 |
| A. | 汽油在上层,水在下层,水层无色 | B. | 汽油在下层,水在上层,汽油紫色 | ||
| C. | 汽油在上层,水在下层,汽油层无色 | D. | 汽油在下层,水在下层,汽油紫色 |
| A. | v(SO2)=4 mol/(L•min) | B. | v(O2)=2 mol/(L•min) | ||
| C. | v(SO2)=0.1 mol/(L•min) | D. | v(SO2)=0.1 mol/(L•s) |

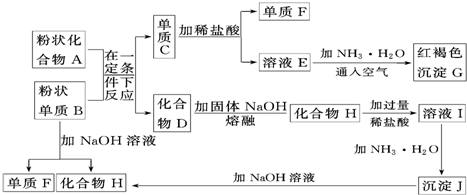
 B.
B. C.
C. D.
D.
 B.
B.