题目内容
6.常温时,下列叙述正确的是( )| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 相同条件下,pH=5的①NH4C1溶液、②CH3C00H溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③ | |
| C. | 体积相同、浓度均为0.1mol/L的盐酸和醋酸,分别稀释m倍、n倍,溶液的pH都变成5,则m<n | |
| D. | pH=5的硫酸溶液稀释到原来的500倍,稀释后溶液中的c(SO42-)与c(H+)之比约为1:10 |
分析 A.加水稀释,氢离子浓度减小,根据Kw=c(H+)×c(OH-)分析;
B.酸抑制水的电离,易水解的盐促进水的电离;
C.相同浓度的盐酸和醋酸,盐酸的pH小于醋酸,根据强弱电解质的性质分析;
D.稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离,所以将pH=5的硫酸溶液稀释500倍后,溶液中的SO42-与H+浓度的比值约为1:10.
解答 解:A.加水稀释,氢离子浓度减小,Kw=c(H+)×c(OH-)不变,所以c(OH-)增大,故A错误;
B.相同条件下,pH=5的①NH4C1溶液、②CH3C00H溶液、③稀盐酸溶液,酸抑制水的电离,氢离子浓度相同对水的抑制的程度相同,易水解的盐促进水的电离,所以由水电离出的c(H+):①>②=③,故B错误;
C.体积相同、浓度均为0.1mol/L的盐酸和醋酸,醋酸部分电离,盐酸完全电离,所以盐酸的pH小于醋酸,稀释后,溶液的pH相同,说明稀释的体积盐酸大于醋酸,即m>n,故C错误;
D.pH为5的溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=5×10-6mol/L;溶液稀释500倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=1×10-8mol/L,所以稀释后溶液中硫酸根离子与氢离子浓度之比为:1×10-8mol/L:1×10-7mol/L=1:10,故D正确.
故选D.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确弱电解质的电离平衡及其影响因素.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
16.关于下列装置的说法中错误的是( )
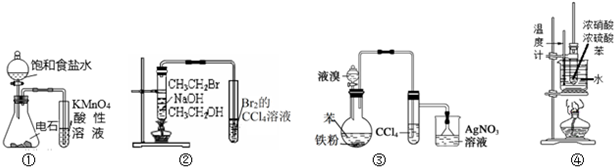

| A. | 装置①可用于检验乙炔的还原性 | |
| B. | 装置②可以证明CH3CH2Br发生消去反应生成了乙烯 | |
| C. | 装置③可以证明苯生成溴苯的反应是取代反应 | |
| D. | 装置④可用于实验室制备硝基苯 |
17.2016年1月起,太原市出租车更换为新能源汽车,该汽车行驶所需的能量来自( )


| A. | 煤 | B. | 电能 | C. | 汽油 | D. | 天然气 |
14.X、Y、Z、W均为短周期元素,X+、Y2+、Z-、W2-具有相同的核外电子排布,下列比较中正确的是( )
| A. | 稳定性H2W<HZ | B. | 原子半径Y<Z | C. | 单质的还原性X<Y | D. | 最外层电子数Z<W |
1.合成氨是人类科学技术上的一项重大突破,曾三次获诺贝尔化学奖,下列说法错误的是( )
| A. | 合成氨技术实现了“从空气到面包” | |
| B. | 合成氨涉及氧化还原反应 | |
| C. | 高效催化剂是合成氨反应的重要条件 | |
| D. | 合成氨所需要的氢气主要来自于电解水 |
11.科学家发现C60后,近年又合成了许多球形富勒烯分子,如C70等,下列对C70说法正确的是( )
| A. | 它与金刚石互为同素异形体 | |
| B. | 它与C60互称同分异构体 | |
| C. | 它与C60的物理性质与化学性质完全相同 | |
| D. | 它与13C互为同位素 |
18.下列各组反应(表中物质均为反应物),在反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状)mol | 酸的浓度及体积 | 反应温度 | |
| A | Zn 0.1 | 6mol/L硝酸 10mL | 70℃ |
| B | Zn 0.1 | 3mol/L硫酸 10mL | 70℃ |
| C | Fe 0.1 | 3mol/L盐酸 10mL | 60℃ |
| D | Zn 0.1 | 3mol/L盐酸 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
15.在短周期主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数,这四种元素原子的最外层电子数之和为20.下列判断中正确的是( )
| A. | 原子半径:丙>乙>甲>丁 | |
| B. | 气态氢化物的熔点:丙>甲 | |
| C. | 乙元素在自然界中形成的化合物种类最多 | |
| D. | 乙和甲、丙、丁都一定能形成两种或两种以上的共价化合物 |
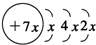 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则. .
.