题目内容
2.金属钠保存在煤油里,原因隔绝空气中的氧气和水蒸气,防止其与钠反应.分析 根据钠的保存需要考虑钠的性质,如钠与空气和水发生反应,与四氯化碳、汽油、煤油不反应,钠的密度比四氯化碳小、比煤油、汽油的密度大以及汽油的沸点低于煤油,易挥发.
解答 解:金属钠与煤油不反应,且密度比煤油大,沉于煤油底部,隔绝空气中的氧气和水蒸气,所以钠能保存在煤油中,故答案为:煤油; 隔绝空气中的氧气和水蒸气,防止其与钠反应.
点评 本题考查试剂的存放,明确物质的性质与保存方法的关系是解答本题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列说法中正确的是( )
| A. | Na2S2O3 (aq)+2HCl(aq)=2NaCl(aq)+S(s)+SO2(g)+H2O(l)在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反 应方向移动 | |
| B. | 若在恒容容器中发生反应:N2(g)+3H2(g)?2NH3 (g),达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率一时间图象可用图一表示 | |
| D. | 若在恒压容器中发生反应:2SO3 (g)?2SO2 (g)+O2 (g),达到平衡后再充人适量He,其速率一时间图象可用图二表示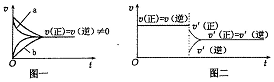 |
13.NaNO2+NH4Cl═NaCl+N2+2H2O.下列关于该反应的说法中,正确的是( )
| A. | NH4Cl中的N元素被还原 | |
| B. | 生成1 mol N2时转移的电子数为6 mol | |
| C. | NaNO2是氧化剂 | |
| D. | N2既是氧化剂又是还原剂 |
10.密度为1.45g/cm3的硫酸溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止,过滤,已知滤液与原BaCl2溶液的质量相等,则原硫酸溶液的物质的量浓度为( )
| A. | 3.2mol/L | B. | 6.2mol/L | C. | 14.8mol/L | D. | 18.4mol/L |
17.可用于鉴别MgCl2和Al2(SO4)3两种溶液的试剂是( )
| A. | 氨水 | B. | H2SO4 | C. | NaOH溶液 | D. | HNO3溶液 |
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-1 KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- | |
| C. | 在无色透明溶液中:Ba2+、Ca2+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液:K+、NH+4、I-、SCN- |
14.下列有关NaClO和NaCl混合溶液的叙述正确的是( )
| A. | 该溶液中,H+、NH4+、Ag+可以大量共存 | |
| B. | 向该溶液中通入CO2,不发生化学反应 | |
| C. | 该溶液可作游泳池及环境的消毒剂,有效成分是NaCl | |
| D. | 常温下,将氯气通入NaOH溶液中可以得到该溶液 |
12.有关卤素的说法正确的是( )
| A. | 卤素是典型的非金属元素,其单质只具有氧化性而无还原性 | |
| B. | 卤素单质的熔点随相对分子质量的增大而升高 | |
| C. | 卤化银都不溶于水,也不溶于稍硝酸 | |
| D. | 卤化氢的水溶液都是强酸 |
 ;
;