题目内容
下列有关说法正确的是
A.对于2SO2(g)+O2(g) 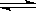 2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B.Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
B
【解析】
试题分析:A、由于反应为可逆反应,故冲入1摩尔二氧化硫时,反应的二氧化硫到1摩尔,所以放出的热量比Q/2小,故不选A;B、该反应时自发的氧化还原反应,故可以实现化学能转变为电能,故选B;C、由于反应放热,升高温度,平衡向逆向移动,氢气的转化率减小,速率增大,故不选C;D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是吸热热反应,故不选D。
考点:反应热的计算,条件对速率和平衡的影响,电离平衡。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目

 2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0)
2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0)  2SO2(g) + O2(g) ΔH = + Q2 kJ·mol-1 (Q2>0)
2SO2(g) + O2(g) ΔH = + Q2 kJ·mol-1 (Q2>0) 4NO(g) + 6H2O(g) ΔH =-Q3 kJ·mol-1 (Q3>0)
4NO(g) + 6H2O(g) ΔH =-Q3 kJ·mol-1 (Q3>0) C(s) + H2O(g) ΔH = + Q4 kJ·mol-1 (Q4>0)
C(s) + H2O(g) ΔH = + Q4 kJ·mol-1 (Q4>0)
