题目内容
下列有关电解质溶液的说法正确的是( )
| A、在蒸馏水中滴加浓H2SO4,KW不变 |
| B、CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C、25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸>VNaOH |
| D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、水的离子积常数只与温度有关,温度升高,水的离子积常数增大;
B、碳酸钙难溶于稀硫酸,易溶于醋酸;
C、醋酸溶液与NaOH溶液恰好反应时溶液呈碱性,若使溶液呈中性,则酸过量;
D、酸或碱抑制水电离,含有弱根离子的盐促进水电离.
B、碳酸钙难溶于稀硫酸,易溶于醋酸;
C、醋酸溶液与NaOH溶液恰好反应时溶液呈碱性,若使溶液呈中性,则酸过量;
D、酸或碱抑制水电离,含有弱根离子的盐促进水电离.
解答:
解:A、水的电离是吸热反应,升高温度促进水电离,浓硫酸在水中稀释放出热量,所以水的离子积常数变大,故A错误;
B、硫酸钙微溶于水,故碳酸钙难溶于硫酸,但是碳酸钙存在溶解平衡,加入醋酸,氢离子与碳酸根结合生成二氧化碳,促进碳酸钙的溶解,钙易溶于水,所以碳酸钙易溶于醋酸,故B错误;
C、醋酸溶液与NaOH溶液恰好反应时溶液呈碱性,若使溶液呈中性,则酸过量,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)>V(NaOH),故C正确;
D、氯化钠是强酸强碱盐,对水的电离无影响,醋酸铵是弱酸弱碱盐,促进水电离,故D错误;
故选C.
B、硫酸钙微溶于水,故碳酸钙难溶于硫酸,但是碳酸钙存在溶解平衡,加入醋酸,氢离子与碳酸根结合生成二氧化碳,促进碳酸钙的溶解,钙易溶于水,所以碳酸钙易溶于醋酸,故B错误;
C、醋酸溶液与NaOH溶液恰好反应时溶液呈碱性,若使溶液呈中性,则酸过量,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)>V(NaOH),故C正确;
D、氯化钠是强酸强碱盐,对水的电离无影响,醋酸铵是弱酸弱碱盐,促进水电离,故D错误;
故选C.
点评:本题考查弱电解质的电离,根据水电离特点、难溶电解质的溶解平衡原理、质子守恒来分析解答即可,难度中等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列说法不正确的是( )
| A、Ksp与温度有关 |
| B、由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C、向AgCl沉淀的溶解平衡中加入NaCl固体,AgCl平衡不移动 |
| D、若在Ca(OH)2溶液与FeCl2溶液中加足量稀硝酸,无沉淀产生 |
已知Ksp(Ag2CrO4)=9.0×10-12,将等体积的4×10-3mol?L-1的AgNO3溶液和4×10-3mol?L-1的K2CrO4溶液混合,下列说法正确的是( )
| A、恰好形成Ag2CrO4饱和溶液 |
| B、能析出Ag2CrO4沉淀 |
| C、不能析出Ag2CrO4沉淀 |
| D、无法确定能否析出Ag2CrO4沉淀 |
下列说法正确的是( )
| A、海南岛四面环海,水资源丰富,不必节约用水 |
| B、明矾既能沉降水中的悬浮物,又能杀菌消毒 |
| C、可通过长期饮用含Ca2+浓度较高的水来补钙 |
| D、若不慎接触敌敌畏或甲胺磷,最好用碱性肥皂液清洗 |
①已知t℃时AgCI的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )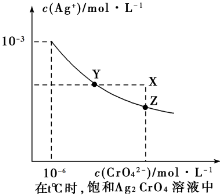

| A、在t℃时,Ag2CrO4的Ksp为1×10-9 |
| B、在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
| C、在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/LKCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀 |
| D、在t℃时,反应Ag2CrO4(s)+2 Cl-(aq)?2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 |
关于中和热测定的说法错误的是( )
| A、实验需用到的主要玻璃仪器包括大、小烧杯,温度计,环形玻璃搅拌棒及泡沫塑料板、碎泡沫塑料(或硬纸板、碎纸条)等 |
| B、盐酸与某强碱中和放出的热量随反应物用量的改变而改变,但中和热不变 |
| C、NaOH稍过量的目的是保证盐酸完全被NaOH中和 |
| D、测定结果准确与否的关键是尽量减小热量损失及准确读取混合溶液的最高温度等 |
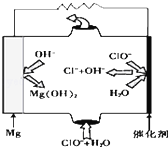 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
