题目内容
8.现有一物质的核磁共振氢谱如图所示,则它可能是( )
| A. | CH3CH2CH3 | B. | CH3CH2CH2OH | C. | (CH3)2CHCH3 | D. | CH3CH2CHO |
分析 由核磁共振氢谱图可知,分子中含4种峰,则分子中含4种H,以此来解答.
解答 解:A.CH3CH2CH3含2种H,故A不选;
B.CH3CH2CH2OH中含4种H,故B选;
C.(CH3)2CHCH3中含2种H,故C不选;
D.CH3CH2CHO中含3种H,故D不选;
故选B.
点评 本题考查有机物的结构,为高频考点,把握核磁共振氢谱及H的种类为解答的关键,侧重分析与应用能力的考查,注意有机物结构对称性的判断,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
19.放射性同位素钬${\;}_{67}^{166}$Ho,该同位素原子内的中子数与核外电子数之差为( )
| A. | 38 | B. | 32 | C. | 99 | D. | 166 |
16.元素单质及其化合物有广泛用途,请回答下列问题:
(1)第三周期元素中,钠原子核外有4种能量不同的电子;氯原子的最外层电子排布式为3S23p5;由这两种元素组成的化合物的电子式为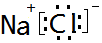 .
.
(2)下列气体能用浓硫酸干燥的是CD.
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱与盐酸反应,钠的反应速率大,镁的反应速率慢.
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时可分解生成两种盐,化学方程式为:KClO3$\stackrel{400℃}{→}$ KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为3:1.
(5)已知:
工业上电解MgCl2制单质镁,而不电解MgO的原因是MgO的熔点比MgCl2的熔点高,MgO熔融时耗费更多能源,增加成本.
(1)第三周期元素中,钠原子核外有4种能量不同的电子;氯原子的最外层电子排布式为3S23p5;由这两种元素组成的化合物的电子式为
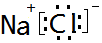 .
.(2)下列气体能用浓硫酸干燥的是CD.
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱与盐酸反应,钠的反应速率大,镁的反应速率慢.
(4)KClO3可用于实验室制O2,若不加催化剂,400℃时可分解生成两种盐,化学方程式为:KClO3$\stackrel{400℃}{→}$ KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为3:1.
(5)已知:
| 化合物 | MgO | MgCl2 |
| 类型 | 离子化合物 | 离子化合物 |
| 熔点/℃ | 2800 | 714 |
13.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是 .如果要合成
.如果要合成 ,所用的原始原料可以是( )
,所用的原始原料可以是( )
 .如果要合成
.如果要合成 ,所用的原始原料可以是( )
,所用的原始原料可以是( )| A. | 2,3-二甲基-1,3-丁二烯和乙烯 | B. | 2,3-二甲基-1,3-丁二烯和乙炔 | ||
| C. | 1,3-丁二烯和2-丁炔 | D. | 1,3-丁二烯和2-丁烯 |
20.元素周期表和元素周期律可以指导人们进行规律性的推测和判断,下列说法不合理的是( )
| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | 卤族元素的最高正化合价等于其主族序数 | |
| C. | 元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 | |
| D. | Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 |
17.下列有关叙述正确的是( )
| A. | NH4F溶液不能存放于玻璃试剂瓶中 | |
| B. | 氮元素的非金属性强于磷,在常温下氮气活泼性也强于磷 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| D. | 二氧化硫和次氯酸的漂白原理不同,二氧化硫漂白时没有发生化学变化 |
 钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题:
钛是一种非常优越的金属,尤其是抵抗海水腐蚀的能力很强,被称为继铁、铝之后的第三金属.回答下列问题: