题目内容
下列有关钢铁腐蚀的叙述正确的是( )
| A、钢柱在水下部分比在空气与水交界处更容易腐蚀 |
| B、与铜质水龙头连接处的钢质水管不易发生腐蚀 |
| C、可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| D、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:A.空气和水是钢铁发生腐蚀的条件;
B.作原电池负极的金属加速被腐蚀,作正极的金属被保护;
C.作电解池阳极的金属加速被腐蚀,作电解池阴极的金属被保护;
D.作原电池负极的金属加速被腐蚀,作正极的金属被保护.
B.作原电池负极的金属加速被腐蚀,作正极的金属被保护;
C.作电解池阳极的金属加速被腐蚀,作电解池阴极的金属被保护;
D.作原电池负极的金属加速被腐蚀,作正极的金属被保护.
解答:
解:A.空气和水是钢铁发生腐蚀的条件,其它条件相同时,氧气浓度越大,钢铁腐蚀越严重,空气和水交界处氧气浓度大于水下,所以钢柱在水下部分比在空气与水交界处更不容易腐蚀,故A错误;
B.Fe、Cu和电解质溶液构成原电池,铁易失电子作负极,加速被腐蚀,故B错误;
C.作电解池阳极的金属加速被腐蚀,作电解池阴极的金属被保护,将地下输油钢管与外加直流电源的正极,则钢管作阳极,加速被腐蚀,故C错误;
D.作原电池负极的金属加速被腐蚀,作正极的金属被保护,锌、Fe和电解质溶液构成原电池,锌易失电子作负极、Fe作正极,所以Fe被保护,故D正确;
故选D.
B.Fe、Cu和电解质溶液构成原电池,铁易失电子作负极,加速被腐蚀,故B错误;
C.作电解池阳极的金属加速被腐蚀,作电解池阴极的金属被保护,将地下输油钢管与外加直流电源的正极,则钢管作阳极,加速被腐蚀,故C错误;
D.作原电池负极的金属加速被腐蚀,作正极的金属被保护,锌、Fe和电解质溶液构成原电池,锌易失电子作负极、Fe作正极,所以Fe被保护,故D正确;
故选D.
点评:本题考查金属腐蚀与防护,明确金属腐蚀原理即可解答,原电池正极和电解池阴极被保护,知道常见防止金属腐蚀的方法,学以致用.

练习册系列答案
相关题目
下列推断正确的是( )
| A、NH3、HCl的水溶液都能导电,但NH3不是电解质 |
| B、Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D、新制氯水和SO2都具有漂白性,都能使紫色石蕊试液褪色 |
设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A、室温下,1mol SO3含有的分子数为NA个 |
| B、0.1molAl3+离子含有核外电子数为NA个 |
| C、1molCl2与1mol Fe反应,转移电子为3 NA个 |
| D、标准状况下2.24L己烷含有分子数目为0.1 NA个 |
实验是研究化学的基础,下列图中所示的实验方法、装置或操作中正确的是( )
A、 制备乙酸乙酯 制备乙酸乙酯 |
B、 测定中和热 |
C、 测定反应速率 |
D、 分离溴乙烷和水 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,22.4 L水中含有的水分子数为NA |
| C、标准状况下,22.4 L氯化氢所含的原子数为NA |
| D、32 g O2所含的氧原子数目为2NA |
下列试剂不能长期贮存在玻璃瓶中的是( )
| A、浓盐酸 | B、浓硫酸 |
| C、浓氢氧化钠溶液 | D、浓食盐水 |
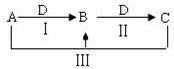 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).