题目内容
常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠.通过计算,分析和比较上表3组数据,给出结论.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
考点:探究物质的组成或测量物质的含量
专题:
分析:根据n=
计算各组实验中NaCl的物质的量,进而确定氢氧化钠的物质的量,再根据M=
计算各组氢氧化钠样品的摩尔质量,据此确定是否含有结晶水,确定样品组成进而得出结论.
| m |
| M |
| m |
| n |
解答:
解:实验①中NaCl的物质的量=
=0.06mol,由钠离子守恒,故NaOH样品的物质的量为0.06mol,氢氧化钠样品的摩尔质量=
=40g/mol,故为所取氢氧化钠样品为NaOH;
实验②中NaCl的物质的量=
=0.04mol,由钠离子守恒,故NaOH样品的物质的量为0.04mol,氢氧化钠样品的摩尔质量=
=58g/mol,故为所取氢氧化钠样品含有结晶水,结晶水数目=
=1,故所取氢氧化钠样品应是NaOH.H2O;
实验③中NaCl的物质的量=
=0.06mol,由钠离子守恒,故NaOH样品的物质的量为0.06mol,氢氧化钠样品的摩尔质量=
=58g/mol,故为所取氢氧化钠样品含有结晶水,结晶水数目=
=1,故所取氢氧化钠样品应是NaOH.H2O,
由上述分析,可得出结论:实验①所取氢氧化钠样品为NaOH、实验②③所取氢氧化钠样品为NaOH.H2O,
答:可得出结论:实验①所取氢氧化钠样品为NaOH、实验②③所取氢氧化钠样品为NaOH.H2O.
| 3.51g |
| 58.5g/mol |
| 2.4g |
| 0.06mol |
实验②中NaCl的物质的量=
| 2.34g |
| 58.5g/mol |
| 2.32g |
| 0.04mol |
| 58-40 |
| 18 |
实验③中NaCl的物质的量=
| 3.51g |
| 58.5g/mol |
| 3.48g |
| 0.06mol |
| 58-40 |
| 18 |
由上述分析,可得出结论:实验①所取氢氧化钠样品为NaOH、实验②③所取氢氧化钠样品为NaOH.H2O,
答:可得出结论:实验①所取氢氧化钠样品为NaOH、实验②③所取氢氧化钠样品为NaOH.H2O.
点评:本题考查物质组成的确定,关键是确定氢氧化钠样品中结晶水问题,侧重考查学生对实验数据分析处理能力,难度中等.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
| A、盐酸、天然气、醋酸、干冰 |
| B、胆矾、漂白粉、氯化钾、氯气 |
| C、氯化钠、汽油、硫酸钡、乙醇 |
| D、氢氧化钠、空气、苛性钾、石灰石 |
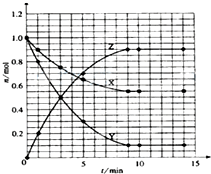 I、已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.0kJ?mol-1
I、已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.0kJ?mol-1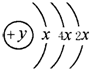 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:

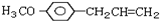 )医学上又叫升白宁,对肿瘤患者化疗和放疗所致的白细胞减少症有较好的疗效.根据题意完成下列填空:
)医学上又叫升白宁,对肿瘤患者化疗和放疗所致的白细胞减少症有较好的疗效.根据题意完成下列填空: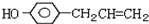 )与甲醇合成升白宁,该反应属于
)与甲醇合成升白宁,该反应属于