题目内容
A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
回答下列问题:
(1)写出下列元素的 符号:A B D
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是 ,碱性最强的是 .
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是 ,电负性最大的元素是 .
(4)D的氢化物比C的氢化物的沸点 (填“高“或“低“),原因
(5)A、B、C最高价氧化物的晶体类型分别是 晶体、 晶体、 晶体
(6)画出D的核外电子排布图 ,这样排布遵循了 原理和 规则.
 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的 符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)A、B、C最高价氧化物的晶体类型分别是
(6)画出D的核外电子排布图
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,
,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,
(1)根据以上推断分析;
(2)元素的非金属性越强,则最高价氧化物对应水化物酸性越强,金属性越强,则碱性越强;
(3)根据同周期第一电离能和电负性的变化规律分析;
(4)分子间形成氢键则沸点较高;
(5)根据微粒间的作用力分析;
(6)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子.
 ,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,
,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,(1)根据以上推断分析;
(2)元素的非金属性越强,则最高价氧化物对应水化物酸性越强,金属性越强,则碱性越强;
(3)根据同周期第一电离能和电负性的变化规律分析;
(4)分子间形成氢键则沸点较高;
(5)根据微粒间的作用力分析;
(6)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子.
解答:
解:A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,则E为Fe元素,
,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,则E为Fe元素,
(1)由上述分析可知,A为Si元素、B为Na元素、D为N元素,故答案为:Si;Na;N;
(2)元素的非金属性越强,则最高价氧化物对应水化物酸性越强,则酸性最强的是HNO3,金属性越强,则碱性越强,则碱性最强的是NaOH;
故答案为:HNO3;NaOH;
(3)同周期自左而右,第一电离能增大(第IIA和第VA族反常),所以第一电离能最大的元素是F,周期自左而右,电负性增大,故电负性最大的元素是F,
故答案为:F;F;
(4)D的氢化物NH3比C的氢化物PH3的沸点高,因为氨气分子间能形成氢键,使氨气的沸点升高,故答案为:NH3;因为氨气分子间形成氢键;
(5)A、B、C最高价氧化物分别为SiO2、Na2O、P2O5晶体类型分别是原子晶体、离子晶体、分子晶体,故答案为:原子;离子;分子;
(6)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子,所以其核外电子排布图为: ,这样排布遵循了泡利不相容原理、洪特规则,
,这样排布遵循了泡利不相容原理、洪特规则,
故答案为: ;泡利;洪特.
;泡利;洪特.
 ,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,则E为Fe元素,
,则x=2,所以A的核外电子数为14,A为Si元素;所以A、B、C同为第三周期元素,B是同周期第一电离能最小的元素,则B为Na元素;C为为第三周期元素,C的最外层有三个成单电子,则C为P元素,C、D同主族,则D为N元素;E的外围电子排布式为3d64s2,则E为Fe元素,(1)由上述分析可知,A为Si元素、B为Na元素、D为N元素,故答案为:Si;Na;N;
(2)元素的非金属性越强,则最高价氧化物对应水化物酸性越强,则酸性最强的是HNO3,金属性越强,则碱性越强,则碱性最强的是NaOH;
故答案为:HNO3;NaOH;
(3)同周期自左而右,第一电离能增大(第IIA和第VA族反常),所以第一电离能最大的元素是F,周期自左而右,电负性增大,故电负性最大的元素是F,
故答案为:F;F;
(4)D的氢化物NH3比C的氢化物PH3的沸点高,因为氨气分子间能形成氢键,使氨气的沸点升高,故答案为:NH3;因为氨气分子间形成氢键;
(5)A、B、C最高价氧化物分别为SiO2、Na2O、P2O5晶体类型分别是原子晶体、离子晶体、分子晶体,故答案为:原子;离子;分子;
(6)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子,所以其核外电子排布图为:
 ,这样排布遵循了泡利不相容原理、洪特规则,
,这样排布遵循了泡利不相容原理、洪特规则,故答案为:
 ;泡利;洪特.
;泡利;洪特.
点评:本题考查元素推断、元素周期律、核外电子排布规律、氢键对物理性质的影响、第一电离能和电负性比较等,题目难度中等,根据原子结构和电子排布推断元素是解题的关键,难点是画出核外电子排布图.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
下列有关能量转换的说法错误的是( )
| A、酸碱中和反应放出的能量可设计为原电池转化为电能 |
| B、煤燃烧是化学能转换为热能 |
| C、太阳能热水器是利用太阳能转化为热能 |
| D、可充电电池在充电时是电能转换为化学能,而放电时是化学能转化为电能 |
可逆反应A+B(s)?C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是( )
| A、正反应为放热反应 |
| B、正反应为吸热反应 |
| C、A为气体,C为固体 |
| D、A为固体,C为气体 |
四种短周期元素的性质或结构信息如下表.下列推断错误的是( )
| 元素编号 | 元素性质或结构 |
| T | M层上有2对成对电子 |
| X | 元素最高正价是+7价 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 单质是银白色固体、导电、密度比水小,与水剧烈反应、和氧气反应不同条件下产物不同 |
| A、离子半径从小到大的顺序:Y<Z<T<X |
| B、X、Y形成化合物的晶体类型与X、Z形成化合物的晶体类型不同 |
| C、T的氢化物是同族元素氢化物中沸点最低的 |
| D、X的最高价氧化物对应的水化物是无机含氧酸中的最强酸 |

 有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体.x为周期表前四周期中电负性最小的元素,Z的原子序数为28.
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体.x为周期表前四周期中电负性最小的元素,Z的原子序数为28.
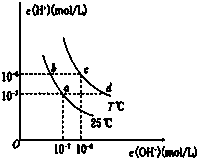 如图表示水溶液中c(H+)与c(OH-)的关系.
如图表示水溶液中c(H+)与c(OH-)的关系.