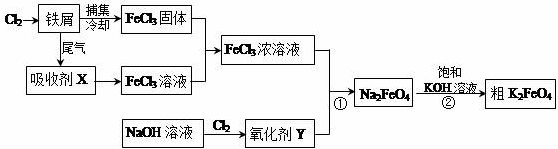
题目内容
6.关于水的离子积常数,下列说法中不正确的是( )| A. | 纯水中c(H+)•c(OH-)=1×10-14 | B. | 25℃纯水中c(H+)•c(OH-)=1×10-14 | ||
| C. | 25℃稀盐酸中c(H+)•c(OH-)=1×10-14 | D. | KW值随温度升高而增大 |
分析 水的离子积Kw只受温度的影响,与所处溶液的酸碱性无关,在25℃时的任何溶液中,Kw=10-14,由于水的电离是吸热的,故升高温度,水的电离被促进,Kw增大.
解答 解:A、Kw的值与温度有关,与溶液的酸碱性无关,故纯水中c(H+)•c(OH-)不一定为1×10-14,只有在25℃是才是1×10-14,故A错误;
B、25℃时的任何溶液中c(H+)•c(OH-)=1×10-14,故B正确;
C、25℃时的任何溶液中c(H+)•c(OH-)=1×10-14,故C正确;
D、由于水的电离是吸热的,故升高温度,水的电离被促进,Kw增大,故D正确.
故选A.
点评 本题考查了水的电离平衡分析,离子积常数影响因素分析判断和计算,掌握基础是解题关键,题目较简单.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案
相关题目
17.对水的电离平衡不产生影响的粒子是( )
| A. | HCl | B. | Fe3+ | C. | Al3+ | D. | Cl- |
14.下列物质分类不正确的是( )
| A. | 氧化物:CaO、SO2 | B. | 酸:H2SO4、HClO | C. | 盐:KCl、CH3COONa | D. | 胶体:豆浆、碘酒 |
1.下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)⑥的最低负价是-2;⑦的最高价含氧酸的化学式为HClO4.
(2)③、④、⑦的简单离子半径由大到小的顺序为Cl->F->Na+用离子符号表示).
(3)⑦的单质电子式为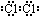 ,由②、④两种元素的原子按1:1组成化合物的电子式为
,由②、④两种元素的原子按1:1组成化合物的电子式为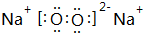 .
.
(4)②、⑥的单质中更易与①的单质反应的是氧气,用原子结构的理论解释原因是同一主族从上到下,原子半径增大,得电子能力减弱,元素的非金属减弱,所以氧气的氧化性比硫强.
(5)④、⑤的最高价氧化物对应水化物之间发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)若用①、②的单质和④的最高价氧化物对应水化物的溶液设计成化学电源,则该电池负极的电极反应式为H2+2OH--2e-=2H2O正极的电极反应式为O2+2H2O+4e-=4OH-.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)③、④、⑦的简单离子半径由大到小的顺序为Cl->F->Na+用离子符号表示).
(3)⑦的单质电子式为
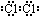 ,由②、④两种元素的原子按1:1组成化合物的电子式为
,由②、④两种元素的原子按1:1组成化合物的电子式为 .
.(4)②、⑥的单质中更易与①的单质反应的是氧气,用原子结构的理论解释原因是同一主族从上到下,原子半径增大,得电子能力减弱,元素的非金属减弱,所以氧气的氧化性比硫强.
(5)④、⑤的最高价氧化物对应水化物之间发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)若用①、②的单质和④的最高价氧化物对应水化物的溶液设计成化学电源,则该电池负极的电极反应式为H2+2OH--2e-=2H2O正极的电极反应式为O2+2H2O+4e-=4OH-.
11.下列化学实验基本操作正确的是( )
①把烧杯放在铁圈上直接加热;
②点燃可燃性气体前,不一定要先检验气体纯度;
③给试管里的液体加热,液体的体积应该超过试管容积的$\frac{2}{3}$;
④用完酒精灯,必须用灯帽盖灭,不可用嘴去吹灭;
⑤制取氧气结束后,应立刻把装反应物的试管用冷水冲洗干净;
⑥进行细铁丝在氧气中燃烧的实验之前,要预先在集气瓶中装少量的水.
①把烧杯放在铁圈上直接加热;
②点燃可燃性气体前,不一定要先检验气体纯度;
③给试管里的液体加热,液体的体积应该超过试管容积的$\frac{2}{3}$;
④用完酒精灯,必须用灯帽盖灭,不可用嘴去吹灭;
⑤制取氧气结束后,应立刻把装反应物的试管用冷水冲洗干净;
⑥进行细铁丝在氧气中燃烧的实验之前,要预先在集气瓶中装少量的水.
| A. | ①和② | B. | ②和④ | C. | ④和⑥ | D. | ③和⑤ |
18.不能用胶体的知识解释的现象是( )
| A. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线) | |
| B. | 静电除尘 | |
| C. | 在海水与河水交界处,易形成三角洲 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色 |
15. 我国科研人员以蹄叶囊青为原料先制得化合物Ⅰ再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( )
我国科研人员以蹄叶囊青为原料先制得化合物Ⅰ再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( )
 我国科研人员以蹄叶囊青为原料先制得化合物Ⅰ再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( )
我国科研人员以蹄叶囊青为原料先制得化合物Ⅰ再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( )| A. | 化合物Ⅰ能使酸性KMnO4溶液褪色 | |
| B. | 化合物Ⅰ分子中含有6个手性碳原子 | |
| C. | 化合物Ⅱ一定条件下能发生取代、消去及加成反应 | |
| D. | 检验化合物Ⅱ中是否含化合物Ⅰ可用Br2的CCl4溶液 |
16.下列离子可以大量共存的是( )
| A. | Mg2+ Na+ SO42- OH- | B. | Ca2+K+ HCO3-OH- | ||
| C. | Na+ H+ CH3COO- SO42- | D. | Ba2+ K+NO3-Cl- |