题目内容
某研究性学习小组探究Na2SO4与SO2的反应.
猜想一:从性质的角度来分类,SO2与CO2可分为一类,均属于 ;由此类推:SO2可与Na2O2反应,化学方程式为 .
猜想二:因Na2O2有 性,SO2与Na2O2的反应为:SO2+Na2O2═Na2SO4
【设计实验】
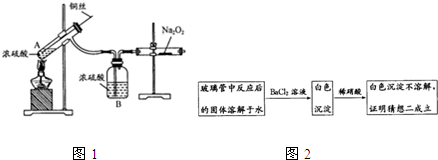
利用下列实验装置如图1,使SO2与Na2O2反应,假设玻璃管内的Na2O2完全反应.
A中反应的化学方程式为 ;这样设计钢丝的目的是 ;实验时A中的现象为 ;该实验置有一明县不足时 .
【验证猜想】利用反应后玻璃管中所得物质:
(1)验证猜想一的实验方案为: ;
(2)验证猜想二的实验方案如图2:
上述实验方案是否合理 (填“合理”或“不合理”),请简要说明理由 .

猜想一:从性质的角度来分类,SO2与CO2可分为一类,均属于
猜想二:因Na2O2有
【设计实验】
利用下列实验装置如图1,使SO2与Na2O2反应,假设玻璃管内的Na2O2完全反应.
A中反应的化学方程式为
【验证猜想】利用反应后玻璃管中所得物质:
(1)验证猜想一的实验方案为:
(2)验证猜想二的实验方案如图2:
上述实验方案是否合理
考点:性质实验方案的设计
专题:实验设计题
分析:猜想一:从性质的角度来分类,SO2与CO2可分为一类,均属于酸性氧化物;根据二氧化碳与过氧化钠的反应书写;
猜想二:因SO2+Na2O2═Na2SO4,所以过氧化钠具有强氧化性;
【设计实验】
浓硫酸与铜在加热条件下生成反应CuSO4、SO2和H2O;钢丝可以上下抽动的原因是可以控制反应的发生和结束;根据A中的反应产物分析实验现象;二氧化硫是有毒气体,所以最后应该增加一个尾气处理装置;
【验证猜想】
(1)验证猜想一只有亚硫酸钠生成,取少量固体产物于试管中,加入适量的蒸馏水溶解,滴加过量的1 mol?L-1稀盐酸,若产生剌激性气味气体,则证明Na2SO3;
(2)验证猜想二只有硫酸钠生成,加氯化钡生成白色沉淀硫酸钡,再加稀硝酸沉淀不溶解,但是由于稀硝酸具有强氧化性,即使开始生成的是亚硫酸钡,再加稀硝酸时也会被氧化成硫酸钡而不溶解,据此分析;
猜想二:因SO2+Na2O2═Na2SO4,所以过氧化钠具有强氧化性;
【设计实验】
浓硫酸与铜在加热条件下生成反应CuSO4、SO2和H2O;钢丝可以上下抽动的原因是可以控制反应的发生和结束;根据A中的反应产物分析实验现象;二氧化硫是有毒气体,所以最后应该增加一个尾气处理装置;
【验证猜想】
(1)验证猜想一只有亚硫酸钠生成,取少量固体产物于试管中,加入适量的蒸馏水溶解,滴加过量的1 mol?L-1稀盐酸,若产生剌激性气味气体,则证明Na2SO3;
(2)验证猜想二只有硫酸钠生成,加氯化钡生成白色沉淀硫酸钡,再加稀硝酸沉淀不溶解,但是由于稀硝酸具有强氧化性,即使开始生成的是亚硫酸钡,再加稀硝酸时也会被氧化成硫酸钡而不溶解,据此分析;
解答:
解:猜想一:从性质的角度来分类,SO2与CO2可分为一类,均属于酸性氧化物;根据二氧化碳与过氧化钠的反应2CO2+2Na2O2═2Na2CO3+O2,所以SO2可与Na2O2反应为2SO2+2Na2O2═2Na2SO3+O2,故答案为:酸性氧化物;2SO2+2Na2O2═2Na2SO3+O2;
猜想二:因SO2+Na2O2═Na2SO4,所以过氧化钠具有强氧化性,故答案为:强氧化性;
【设计实验】
浓硫酸与铜在加热条件下生成反应CuSO4、SO2和H2O,方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;钢丝可以上下抽动的原因是可以控制反应的发生和结束;根据A中的反应产物CuSO4和SO2,所以现象为铜丝上有气泡冒出,溶液变蓝色;二氧化硫是有毒气体,所以最后应该增加一个尾气处理装置;
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;铜丝上下抽动,便于控制反应的发生和结束;铜丝上有气泡冒出,溶液变蓝色;没有尾气处理,将造成环境污染;
【验证猜想】
(1)验证猜想一只有亚硫酸钠生成,取少量固体产物于试管中,加入适量的蒸馏水溶解,滴加过量的1 mol?L-1稀盐酸,若产生剌激性气味气体,则证明Na2SO3,故答案为:取少量固体产物于试管中,加入适量的蒸馏水溶解,滴加过量的1 mol?L-1稀盐酸,若产生剌激性气味气体,则证明猜想一成立;
(2)验证猜想二只有硫酸钠生成,加氯化钡生成白色沉淀硫酸钡,再加稀硝酸沉淀不溶解,但是由于稀硝酸具有强氧化性,即使开始生成的是亚硫酸钡,再加稀硝酸时也会被氧化成硫酸钡而不溶解,所以不合理,故答案为:不合理;若生成的是亚硫酸钠,加氯化钡生成白色的亚硫酸钡沉淀,再加稀硝酸时也会被氧化成硫酸钡,沉淀同样不溶解;
猜想二:因SO2+Na2O2═Na2SO4,所以过氧化钠具有强氧化性,故答案为:强氧化性;
【设计实验】
浓硫酸与铜在加热条件下生成反应CuSO4、SO2和H2O,方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
【验证猜想】
(1)验证猜想一只有亚硫酸钠生成,取少量固体产物于试管中,加入适量的蒸馏水溶解,滴加过量的1 mol?L-1稀盐酸,若产生剌激性气味气体,则证明Na2SO3,故答案为:取少量固体产物于试管中,加入适量的蒸馏水溶解,滴加过量的1 mol?L-1稀盐酸,若产生剌激性气味气体,则证明猜想一成立;
(2)验证猜想二只有硫酸钠生成,加氯化钡生成白色沉淀硫酸钡,再加稀硝酸沉淀不溶解,但是由于稀硝酸具有强氧化性,即使开始生成的是亚硫酸钡,再加稀硝酸时也会被氧化成硫酸钡而不溶解,所以不合理,故答案为:不合理;若生成的是亚硫酸钠,加氯化钡生成白色的亚硫酸钡沉淀,再加稀硝酸时也会被氧化成硫酸钡,沉淀同样不溶解;
点评:本题考查学生对实验原理与装置的理解、物质组成的测定等、实验方案设计等,难度中等,理解原理是关键,需要学生具有扎实的基础知识与综合运用知识分析解决问题的能力,难度较大.

练习册系列答案
相关题目
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、碱性氧化物 五氧化二磷 P2O5 |
| B、酸性氧化物 干冰 CO2 |
| C、酸 硫酸 H2S |
| D、碱 纯碱 Na2CO3 |
相同温度下,物质的量浓度均为1mol?L-1盐酸、硫酸、醋酸三种溶液,导电能力大小关系( )
| A、盐酸=硫酸=醋酸 |
| B、硫酸>盐酸>醋酸 |
| C、盐酸>硫酸>醋酸 |
| D、醋酸>盐酸>硫酸 |
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究. 如图为化学反应气体体积测定仪.
如图为化学反应气体体积测定仪.