题目内容
20.展望21世纪,新材料是高新技术的突破口,只有更好地开发和应用具有特殊性能的新材料,才能拥有更强大的经济实力和技术潜力.下列各学科中对于新材料的开发和研制具有独特优势的学科是( )| A. | 物理 | B. | 化学 | C. | 地理 | D. | 生物 |
分析 化学变化中会有新物质生成,通过化学方法可以合成新材料,据此分析.
解答 解:化学变化中会有新物质生成,通过化学方法可以合成新材料,所以对于新材料的开发和研制具有独特优势的学科是化学学科,故B正确;
故选B.
点评 本题考查了化学变化的特点以及化学反应的应用,题目难度不大,注意对基础知识的归纳积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,2.24LC2H4和C2H2的混合气体中含碳原子数目小于0.2NA | |
| B. | 100mL1.0mol/L的FeCl3溶液与足量Cu反应,转移电子数数为0.2NA | |
| C. | 标况下44.8mL氯气通入足量水中发生反应,转移电子数为2×10-3NA | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02NA |
11.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品,加入足量水,仍有部分固体未溶解:过滤后,向所得固体中加入足量氢氧化钠溶液,固体全部溶解;
②另取少量样品加入足量氢氧化钠溶液,振荡后仍有固体存在.
该白色粉末可能为( )
①取少量样品,加入足量水,仍有部分固体未溶解:过滤后,向所得固体中加入足量氢氧化钠溶液,固体全部溶解;
②另取少量样品加入足量氢氧化钠溶液,振荡后仍有固体存在.
该白色粉末可能为( )
| A. | Ca(HCO3)2、Al(OH)3 | B. | Al(OH)3、NaHCO3 | C. | Na2SO3、Mg(OH)2 | D. | Na2CO3、CuSO4 |
8. 在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
 在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | .原溶液的c(H+)=0.08mol/L | B. | 原溶液中n(Mg2+):n(Al3+)=10:1 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.066mol/L |
5.国际相对原子质量表上查得的氢(H)是1.008,这是指( )
| A. | 同位素1H的相对原子质量 | |
| B. | 氢元素的平均相对原子质量 | |
| C. | 氢元素各同位素质量数与百分含量算出的平均值 | |
| D. | 同位素2H的相对原子质量 |
12.2016年诺贝尔化学奖授予借助某些金属离子制造出复杂新分子,从而合成分子机器的三位科学家,合成新分子过程模拟如下:

下列有关信息错误的是( )

下列有关信息错误的是( )
| A. | 图中新月形分子和环状分子“组合”在一起,铜离子起关键作用 | |
| B. | 利用此方式可以合成新分子,同时也可能创造一种全新“机械键” | |
| C. | 在创造新分子技术中,铜离子是唯一可以借助的金属离子 | |
| D. | 此技术可以“互锁”合成 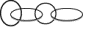 分子,甚至成更复杂的分子 分子,甚至成更复杂的分子 |
10.将C(H+)相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸)分别与锌反应,若最后有一溶液中有锌剩余,且放出的气体一样多,对此有如下判断:
(1)反应所需时间:乙<甲
(2)开始时反应速率:甲>乙
(3)参加反应的锌的质量:甲=乙
(4)整个反应阶段的平均速率:乙>甲
(5)盛盐酸的容器中有锌剩余
(6)盛醋酸的容器中有锌剩余.
以上判断正确的是( )
(1)反应所需时间:乙<甲
(2)开始时反应速率:甲>乙
(3)参加反应的锌的质量:甲=乙
(4)整个反应阶段的平均速率:乙>甲
(5)盛盐酸的容器中有锌剩余
(6)盛醋酸的容器中有锌剩余.
以上判断正确的是( )
| A. | (1)(2)(3)(5) | B. | (1)(3)(5) | C. | (2)(3)(6) | D. | (1)(3)(4)(5) |
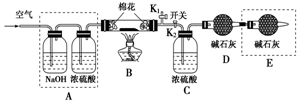 为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x
为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x