题目内容
6.化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( )| A. | K越大,反应物的转化率越小 | B. | K与反应物的浓度有关 | ||
| C. | K与生成物的浓度有关 | D. | K与温度有关 |
分析 化学平衡常数K只与温度有关,可衡量反应正向进行的程度,K越大,正向进行的程度越大,以此来解答.
解答 解:A.K越大,正向进行的程度越大,则反应物的转化率越大,故A错误;
B.K与反应物的浓度无关,故B错误;
C.K与生成物的浓度无关,故C错误;
D.K只与温度有关,温度变化,则K发生变化,故D正确;
故选D.
点评 本题考查化学平衡常数K的意义,为高频考点,把握K的影响因素及意义为解答的关键,侧重分析与应用能力的考查,注意K的表达式与方程式的书写有关,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 标准状况下,22.4LSO3含有的分子数为NA | |
| B. | 常温常压下,7.8gNa2O2含有的阴离子数目为0.2NA | |
| C. | 将含lmol FeCl3的溶液制得的Fe(OH)3胶体中含胶粒数为NA(假设所有的FeCl3都转化为Fe(OH)3胶体) | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA |
17.下列说法中正确的是( )
| A. | 1mol O的质量是16 g/mol | B. | Na+的摩尔质量是23 g/mol | ||
| C. | CO2的质量是44 g/mol | D. | 氢的摩尔质量是2 g/mol |
14.下列离子在溶液中可以大量共存的一组是( )
| A. | H+、Na+、CO32- | B. | K+、NO3-、Cl- | ||
| C. | Na+、Fe3+、OH- | D. | Ba2+、SO42-、HCO3- |
18.某课外实验小组的同学们采取的下列实验操作中,正确的是( )
①甲同学将用剩的钠或钾应及时放回原试剂瓶;
②乙同学用灯帽盖灭酒精灯;
③丙同学给容量为30mL的试管中加入20mL液体加热;
④丁同学用酒精萃取碘水中的碘;
⑤戊同学将浓硫酸倒入装有适量水的量筒中稀释;
⑥己同学配制NaOH溶液时,将NaOH固体在烧杯中溶解后,立即注入容量瓶中.
①甲同学将用剩的钠或钾应及时放回原试剂瓶;
②乙同学用灯帽盖灭酒精灯;
③丙同学给容量为30mL的试管中加入20mL液体加热;
④丁同学用酒精萃取碘水中的碘;
⑤戊同学将浓硫酸倒入装有适量水的量筒中稀释;
⑥己同学配制NaOH溶液时,将NaOH固体在烧杯中溶解后,立即注入容量瓶中.
| A. | 只有②③ | B. | ①② | C. | 只有②③④ | D. | 全部正确 |
15.下列说法正确的是( )
| A. | 夏天混用不同品牌的墨水书写时,钢笔的笔尖容易发生堵塞是因为胶体发生了聚沉 | |
| B. | 金属元素的原子只有还原性,其阳离子只有氧化性 | |
| C. | 实验室用托盘天平称量烧碱时,为防止腐蚀托盘,需在托盘上垫上小纸片 | |
| D. | 合金的硬度一般小于它的成分金属,熔点高于它的成分金属 |
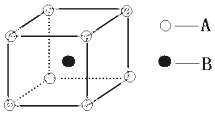 根据离子晶体的晶胞结构,判断下列离子晶体的化学式:AB(A表示阳离子,B表示阴离子).
根据离子晶体的晶胞结构,判断下列离子晶体的化学式:AB(A表示阳离子,B表示阴离子).



