题目内容
17.根据热化学方程式:S(g)+O2(g)═SO2(g)△H=-Q kJ•mol-1,下列分析正确的是( )| A. | 1mol S(g)与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ | |
| B. | 1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出Q kJ的热量 | |
| C. | S(s)+O2(g)=SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个S(g)与1个O2(g)完全反应可以放出Q kJ的热量 |
分析 A、反应放热,反应物能量高;
B、热化学方程式的化学计量数表示物质的量;
C.状态不同反应的焓变不同,放热反应焓变为负值,结合盖斯定律分析判断;
D、热化学方程式的化学计量数只表示物质的量.
解答 解:A、△H<0,反应放热,反应物能量高,故A错误;
B、S(g)+O2(g)═SO2(g)△H=-Q kJ•mol-1,热化学方程式的化学计量数表示物质的量,1mol S(g)与1mol O2(g)反应生成1mol SO2(g)放出Q kJ的热量,故B正确;
C、固体硫变化为气体硫吸热,焓变为负值,S(s)+O2(g)=SO2(g)△H>-Q kJ•mol-1 ,故C错误;
D、热化学方程式的化学计量数表示物质的量,不表示分子个数,故D错误;
故选B.
点评 本题考查对热化学方程式的理解,特别是其化学计量数只表示物质的量.题目难度不大.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
5.下列说法正确的是( )
| A. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 | |
| B. | 有气体参加的化学反应若增大压强(即缩小反应容器的体积),可增加反应物分子中活化分子的百分数从而使反应速率增大 | |
| C. | 增大反应物浓度可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加 | |
| D. | 催化剂不影响反应的活化能,但能增大单位体积内活化分子百分数,增大反应速率 |
12.下列说法不正确的是( )
| A. | 氯气可用于自来水的消毒 | B. | 二氧化硅是半导体材料 | ||
| C. | 氢氧化铁胶体能用于净水 | D. | 二氧化硫可用于漂白纸浆 |
9.认真审题,完成下列实验探究.
(1)探究潮湿氯气与碳酸钠反应的产物
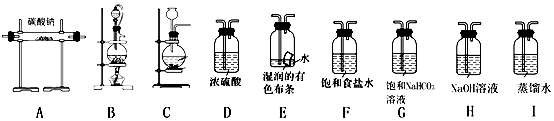
①选择必要的仪器,按BFAH顺序连接好装置(填装置序号).
②写出在该实验情境下,制备氯气的化学方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
③将A中充分反应后的固体物质分成两等份分装于两支试管中.
向其中一支试管中加蒸馏水至固体完全溶解后,滴加BaCl2溶液,无明显现象,再滴加NaOH溶液变浑浊,由此现象推断固体产物中含有NaHCO3;向另一支试管中滴加过量的稀HNO3,再滴加AgNO3溶液,溶液变浑浊,由此现象推断固体产物中含有NaCl;
又已知A中反应还生成黄红色的Cl2O气体,请结合上述成分分析过程,写出潮湿的Cl2和Na2CO3的化学方程式2Cl2+2Na2CO3+H2O=2NaCl+2NaHCO3+Cl2O.
(2)二氧化碳与过氧化钠反应探究.
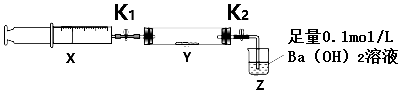
将一定量(过量)二氧化碳充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好.在室温下按如图示装置进行实验.
(1)探究潮湿氯气与碳酸钠反应的产物

①选择必要的仪器,按BFAH顺序连接好装置(填装置序号).
②写出在该实验情境下,制备氯气的化学方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
③将A中充分反应后的固体物质分成两等份分装于两支试管中.
向其中一支试管中加蒸馏水至固体完全溶解后,滴加BaCl2溶液,无明显现象,再滴加NaOH溶液变浑浊,由此现象推断固体产物中含有NaHCO3;向另一支试管中滴加过量的稀HNO3,再滴加AgNO3溶液,溶液变浑浊,由此现象推断固体产物中含有NaCl;
又已知A中反应还生成黄红色的Cl2O气体,请结合上述成分分析过程,写出潮湿的Cl2和Na2CO3的化学方程式2Cl2+2Na2CO3+H2O=2NaCl+2NaHCO3+Cl2O.
(2)二氧化碳与过氧化钠反应探究.
将一定量(过量)二氧化碳充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好.在室温下按如图示装置进行实验.

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | ①淡黄色固体变为白色粉末 | ②反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2 |
| 将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | ③Z中液体出现倒吸 | ④不用解释 |
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1molOH-与1mol-OH所含质子数均为9NA | |
| B. | 0.1mol/L的CuCl2溶液中含Cl-的数目为0.2 NA | |
| C. | 标准状况下,11.2LCCl4中含C-C键的数目为2NA | |
| D. | 10 mL 2mol/LH2O2完全分解,转移的电子数为0.2 NA |
12.下列实验操作能达到实验目的是( )
| A. | 用分液漏斗分离乙醇与油脂的混合物 | |
| B. | 用玻璃棒蘸取次氯酸溶液点在干燥的pH试纸中部,测定次氯酸溶液的pH | |
| C. | 在含FeCl3杂质的MgCl2溶液中加入适量的MgCO3,微热,充分搅拌,静置,过滤得较纯净的MgCl2溶液 | |
| D. | 将甲烷与氯气按物质的量之比1:2通入烧瓶,光照,制取纯净的CH2Cl2 |
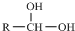 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$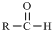 请根据如图回答:
请根据如图回答: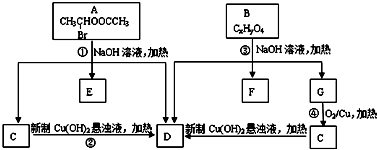
 .
. ;
; .
.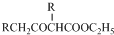 +C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).