��Ŀ����
17��Ŀǰ���ҹ�ˮ��Ⱦ����Ӱ�������ǵ�����ͽ�������ˮ����ҲԽ��Խ�ܵ����ǵĹ�ע���������ˮ�ľ����������������̣�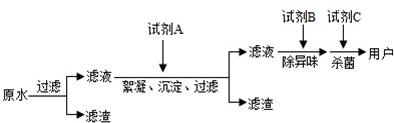
��1���������������ӵ��Լ�A��B�ֱ����ѡ������������̿��
��2����֪��ClO2���۵�Ϊ-59.5�棬�е�Ϊ11�棬��Ư��������������������Cl2ǿ��ʹ�ð�ȫ��Ϊ����ˮ��ȫ��Խ��Խ�������ˮ��ѡ��ClO2��Ϊɱ����������ʵ�����Ʊ�ClO2��װ����ͼ��ʾ��
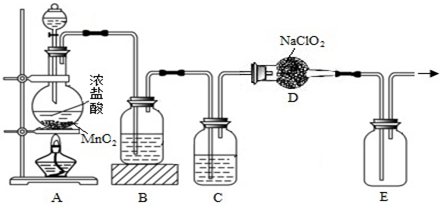
��װ��A�з�Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
������B��ʢ�ŵ��Լ�����ʳ��ˮ��C�����ø���������
����Aװ���Ʊ���Cl2��Dװ���е�NaClO2��Ӧ���Ƶ�ClO2��д��D�з�����Ӧ�Ļ�ѧ����ʽ2NaClO2+Cl2=2ClO2+2NaCl��
��ClO2��Cl2��������ˮ�ľ��������߶�Ӧ�Ļ�ԭ�����ΪCl-�������ʵ�����ClO2��Cl2������Ч�ʱ�Ϊ5��2��
���� ��1��ԭˮ�����˺�����Һ�м�����������Ϊ��������ȥ���ʣ�Ȼ��������̿��ȥ��ζ��������ˮɱ�������ɴﵽ��ˮ��Ŀ�ģ�
��2��Ũ�����MnO2�ڼ��������·�Ӧ�Ʊ�Cl2����Ӧ�ķ���ʽΪMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O�������ӡ��������D���������ƹ��巴Ӧ����ClO2������Cl2������CCl4Һ�壬E�������ſշ��ռ���
��� �⣺��1��ԭˮ�����˺�����Һ�м�����������Ϊ��������ȥ���ʣ�Ȼ��������̿��ȥ��ζ��������ˮɱ�������ɴﵽ��ˮ��Ŀ�ģ��ʴ�Ϊ������������̿��
��2��Ũ�����MnO2�ڼ��������·�Ӧ�Ʊ�Cl2����Ӧ�ķ���ʽΪMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O�������ӡ��������D���������ƹ��巴Ӧ����ClO2������Cl2������CCl4Һ�壬E�������ſշ��ռ���
��Ũ�����MnO2�ڼ��������·�Ӧ�Ʊ�Cl2����Ӧ�ķ���ʽΪMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O���ʴ�Ϊ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
�����ɵ������л���HCl��ˮ��Ϊ�Ʊ�����������������������������ڱ���ʳ��ˮ�����ʣ����ñ���ʳ��ˮ��ȥ�����л��е�HCl���ʣ�Ȼ����Ũ��������ȥˮ��
�ʴ�Ϊ������ʳ��ˮ������������
����Aװ���Ʊ���Cl2��Dװ���е�NaClO2��Ӧ���Ƶ�ClO2������ʽΪ2NaClO2+Cl2=2ClO2+2NaCl���ʴ�Ϊ��2NaClO2+Cl2=2ClO2+2NaCl��
��ClO2��Cl2��������ˮ�ľ��������߶�Ӧ�Ļ�ԭ�����ΪCl-��Ԫ�ػ��ϼ۷ֱ���+4�ۡ�0�۽���Ϊ-1�ۣ��仯ֵΪ5��1��������ʵ�����ClO2��Cl2������Ч�ʱ�Ϊ5��2���ʴ�Ϊ��5��2��
���� ���⿼��������Ʊ������ӡ��ռ���ʵ���������Ŀ�ѶȲ���ѧϰ��ע����ջ�ѧʵ�������������������Ŀʱ����ʵ��Ŀ�ĺ�ʵ��ԭ���ǽ����Ŀ�Ĺؼ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д��ٸ����Cl2 ��Na2O2 ��NaClO �ܻ���̿ ��SO2��
| A�� | ���������������� | B�� | ֻ�Тڢۢ� | C�� | ֻ�Т٢ܢ� | D�� | ȫ�� |
| A�� | NaHCO3 | B�� | Fe2��SO4��3 | C�� | NH4HCO3 | D�� | AlCl3 |
| A�� | Al��Fe2O3�ܷ������ȷ�Ӧ������MnO2Ҳ�ܷ������ȷ�Ӧ | |
| B�� | AlCl3�����NaOH��Һ��Ӧ����AlO2-���������NH3•H2O��ӦҲ����AlO2- | |
| C�� | Fe��Cl2��Ӧ����FeCl3������I2��ӦҲ����FeI3 | |
| D�� | Na2O2��CO2��Ӧ����Na2CO3��O2������SO2��ӦҲ����Na2SO3��O2 |
| A�� | ˮ������������� | B�� | �������費���κ��ᷴӦ | ||
| C�� | ����ʯӢ���������������ƹ��� | D�� | ���ά����Ҫ�ɷ��ǹ� |