题目内容
20.CaCO3的摩尔质量是100g/mol.将5.0g CaCO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100ml溶液.该溶液中Ca2+的物质的量浓度是( )| A. | 5.0mol/L | B. | 0.10mol/L | C. | 1.0mol/L | D. | 0.50mol/L |
分析 n(CaCO3)=$\frac{5.0g}{100g/mol}$=0.05mol,CaCO3和稀盐酸反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,根据Ca原子守恒得n(Ca2+)=n(CaCl2)=n(CaCO3)=0.05mol,根据c=$\frac{n}{V}$计算钙离子浓度.
解答 解:n(CaCO3)=$\frac{5.0g}{100g/mol}$=0.05mol,CaCO3和稀盐酸反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,根据Ca原子守恒得n(Ca2+)=n(CaCl2)=n(CaCO3)=0.05mol,c(Ca2+)=$\frac{n}{V}$=$\frac{0.05mol}{0.1L}$=0.50mol/L,故选D.
点评 本题考查物质的量浓度及化学方程式的计算,为高频考点,明确各个物理量之间关系是解本题关键,根据原子守恒计算,也可以根据方程式计算但较麻烦,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.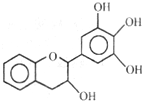 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素( EGC )的结构如图所示.关于 EGC 的下列叙述中不正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素( EGC )的结构如图所示.关于 EGC 的下列叙述中不正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素( EGC )的结构如图所示.关于 EGC 的下列叙述中不正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素( EGC )的结构如图所示.关于 EGC 的下列叙述中不正确的是( )| A. | 能发生加成反应、氧化反应和取代反应 | |
| B. | 遇 FeC13溶液能发生显色反应 | |
| C. | 分子中所有的原子可能共平面 | |
| D. | lmolEGC与4mo1NaOH恰好完全反应 |
11.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向AgNO3溶液中逐滴加入过量氨水
④向硅酸钠溶液中逐滴加入过量的盐酸.
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向AgNO3溶液中逐滴加入过量氨水
④向硅酸钠溶液中逐滴加入过量的盐酸.
| A. | ①② | B. | ①④ | C. | ①③ | D. | ②③ |
8. 膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
 膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇的分子式为C11H12O4,属于芳香族化合物 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面上 | |
| C. | 1mol芥子醇能与足量溴水反应消耗1molBr2 | |
| D. | 芥子醇分子中含9种不同化学环境的H原子 |
5.下列电离方程式书写错误的是( )
| A. | H2SO4═2H++SO42- | B. | Al2(SO4)3═2Al3++3SO42- | ||
| C. | Na2CO3═Na++CO32- | D. | Ba(OH)2═Ba+2+2OH- |
12.下列实验方案的设计中,可行的是( )
| A. | 用分液的方法分离煤油和汽油 | |
| B. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉 | |
| C. | 用溶解、过滤的方法分离K2MnO4和KMnO4固体的混合物 | |
| D. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
9.下列说法正确的是( )
| A. | pH<7的溶液一定是酸性溶液 | |
| B. | 室温时pH=5的溶液和pH=3的相比,前者c(OH-)是后者的100倍 | |
| C. | 室温下,每1×107个水分子中只有一个水分子发生电离 | |
| D. | HCl溶液中无OH-,NaCl溶液中既无OH-也无H+ |