题目内容
20.以下是对重要非金属及其化合物的讨论,根据要求回答问题:(1)实验室盛装NaOH溶液是试剂瓶不能用玻璃塞,应该用橡胶塞,以防止发生反应:SiO2+2OH-=SiO32-+H2O(离子方程式).
(2)氨是一种重要的化工产品,密度比空气小(填“大”或“小”).工业上制备氨气的化学方程式为N2+3H2$?_{催化剂}^{高温、高压}$2NH3.以氨气为原料制备硝酸涉及到的反应有4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、2NO+O2=2NO2、3NO2+H2O═2HNO3+NO
(3)氯碱工业是以电解饱和食盐水为基础的基本化学工业.电解饱和食盐水的产物中一种是所有气体中密度最小的气体、一种是黄绿色气体和一种易溶、易电离的碱,则电解食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑工业上制取漂白粉的反应化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(4)浓H2SO4常用作气体干燥剂,是因为它具有吸水性;将适量的蔗糖放入烧杯中,滴入几滴水,搅拌均匀.然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体.请回答:
①产生刺激性气味气体的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
②根据上述实验现象,表明浓硫酸具有BCD(填序号).
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(5)铜和浓硝酸反应的离子方程式是Cu+4H++2NO3-═Cu2++2NO2↑+2H2O.若参加反应的Cu质量为3.2g,生成NO2气体2.24L(标准状况下),则转移电子物质的量为0.1mol,被还原的与未被还原的HNO3物质的量之比为1:1.
分析 (1)氢氧化钠与二氧化硅反应生成硅酸钠和水,硅酸钠具有粘合性,应该用橡胶塞;
(2)氨气的密度小于空气的密度;工业上用氮气与氢气在高温高压、催化剂的条件下反应生成氨气;氨气催化氧化生成NO,NO氧化生成二氧化氮,二氧化氮与水反应生成硝酸和NO;
(3)电解食盐水生成NaOH、氢气、氯气;工业上用氯气与石灰乳反应制取漂白粉;
(4)浓硫酸具有吸水性,可作干燥剂;浓硫酸具有脱水性、强氧化性,蔗糖碳化后,与浓硫酸发生氧化还原反应;
(5)Cu与浓硝酸反应生成硝酸铜、二氧化氮、水,结合反应及元素化合价变化计算.
解答 解:(1)氢氧化钠与二氧化硅反应生成硅酸钠和水,硅酸钠具有粘合性,应该用橡胶塞,离子反应为SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O;
(2)氨是一种重要的化工产品,密度比空气小,工业上制备氨气的化学方程式为N2+3H2 $?_{催化剂}^{高温、高压}$ 2 NH3,以氨气为原料制备硝酸涉及到的反应有4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、2NO+O2=2NO2、3NO2+H2O═2HNO3+NO,
故答案为:小;N2+3H2 $?_{催化剂}^{高温、高压}$ 2 NH3;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、2NO+O2=2NO2、3NO2+H2O═2HNO3+NO;
(3)电解食盐水的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,工业上制取漂白粉的反应化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)浓硫酸具有吸水性,可作干燥剂;浓硫酸具有脱水性、强氧化性,蔗糖碳化后,与浓硫酸发生氧化还原反应,反应为C+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O,由实验现象可知,表明浓硫酸具有吸水性、脱水性、强氧化性,
故答案为:吸水性; C+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O;BCD;
(5)铜和浓硝酸反应的离子方程式是Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,若参加反应的Cu质量为3.2g,Cu的物质的量为$\frac{3.2g}{64g/mol}$=0.05mol,由反应可知生成NO2气体0.05mol×2×22.4L/mol=2.24L(标准状况下),则转移电子物质的量为0.05mol×(2-0)=0.1 mol,该反应中生成硝酸铜体现酸性,生成二氧化氮体现硝酸的氧化性,且各占一半,则被还原的与未被还原的HNO3物质的量之比为1:1,
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;2.24; 0.1; 1:1.
点评 本题考查氧化还原反应的计算及物质的性质,为高频考点,把握物质的性质、发生的反应、反应原理为解答的关键,侧重分析与应用、计算能力的综合考查,综合性较强,题目难度不大.

| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性R(OH)2<M(OH)2 |
①苯不能使酸性高锰酸钾溶液褪色;
②苯环中6个碳碳键键长完全相同;
③苯能在一定条件下与H2加成生环已烷;
④经实验测得邻二甲苯仅有一种结构;
⑤苯在FeCl3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色;
⑥苯分子约lH-核磁共振谱图中只有一个峰值.
| A. | ②③④⑤ | B. | ①③④⑤⑥ | C. | ①②④⑤ | D. | ①②③④ |
| A. | 液氯 | B. | KClO3 | C. | HCl气体 | D. | 氯水 |
| A. | 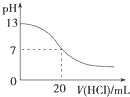 图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. |  图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 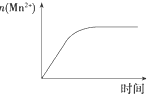 图表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 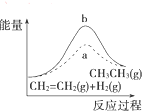 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)-→CH3CH3(g)△H<0使用和未使用催 化剂时,反应过程中的能量变化 |
| A. | 液氯是氯气的水溶液,它能使干燥的有色布条褪色 | |
| B. | 氯气和NaOH溶液反应可制备“84”消毒液 | |
| C. | 氯气可用于自来水的杀菌消毒,是因为氯气的毒性 | |
| D. | 新制饱和氯水在光照下有气泡产生,其主要成分是氯气 |
| A. | 石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O | |
| C. | 氢氧化铜溶于盐酸:Cu2++2OH-+2H+=Cu2++2H2O | |
| D. | 铁屑溶于稀硫酸溶液:2Fe+6H+=2Fe3++3H2↑ |
| A. | c(OH-)可能为0.01 mol/L | B. | c(OH-)可能为1×10-12mol/L | ||
| C. | 该溶液不可能是酸溶液 | D. | 该溶液可能是碱溶液 |