题目内容
14.下列氯化物不能用金属与盐酸反应得到的是( )①FeCl3 ②FeCl2③CuCl2 ④MgCl2.
| A. | ①②③ | B. | ①③ | C. | ②④ | D. | ①④ |
分析 盐酸具有弱氧化性,与变价金属反应生成低价金属氯化物,排在金属活动性顺序表中H前面的金属与盐酸反应,以此来解答.
解答 解:Fe与盐酸反应生成FeCl2,Mg与盐酸反应生成MgCl2,Cu与盐酸不反应,
故选C.
点评 本题考查金属的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
4.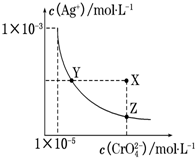 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )| A. | t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为X点 | |
| C. | t℃时,Y点和Z点时Ag2CrO4的Ksp相等 | |
| D. | t℃时,将0.01 mol•L-1 AgNO3溶液滴入20 mL 0.01 mol•L-1 KCl和0.01 mol•L-1 K2CrO4的混合溶液中,CrO42-先沉淀 |
5.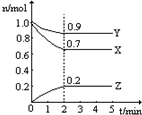 某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为3X+Y?2Z.
(2)从开始至2min,Z的平均反应速率为0.05mol•L-1•min-1.
(3)2min时X的转化率为30%.
(4)下列措施使正反应的速率如何变化?(填“增大”、“减小”或“不变”)
 某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:(1)该反应的化学方程式为3X+Y?2Z.
(2)从开始至2min,Z的平均反应速率为0.05mol•L-1•min-1.
(3)2min时X的转化率为30%.
(4)下列措施使正反应的速率如何变化?(填“增大”、“减小”或“不变”)
| 编号 | 改变的条件 | 正反应的速率 |
| ① | 降低温度 | |
| ② | 增大Y的浓度 | |
| ③ | 使用合适的催化剂 | |
| ④ | 增大容器体积 |
2.以下是在实验室模拟“侯氏制碱法”生产流程的示意图,有关叙述错误的是( )


| A. | A气体是NH3 | |
| B. | 悬浊液的离子主要有Na+、NH4+、Cl-、HCO3- | |
| C. | 第Ⅲ步操为过滤 | |
| D. | 第Ⅳ步操作所使用的仪器主要有铁架台、酒精灯、蒸发皿、玻璃棒 |
9.下溶液中c(Cl-) 与50mL 1mol/L 氯化铝溶液中的c(Cl-) 相等的是( )
| A. | 150 mL 1mol/L氯化钠溶液 | B. | 5 mL 2mol/L 氯化铵溶液 | ||
| C. | 150 mL 1mol/L氯化钾溶液 | D. | 75 mL 1.5mol/L 氯化镁溶液 |
6.在物质分类中,前者包括后者的是( )
| A. | 氧化物、化合物 | B. | 化合物、电解质 | ||
| C. | 溶液、胶体 | D. | 置换反应、氧化还原反应 |
4.胶体区别于其它分散系的本质是( )
| A. | 胶体的分散质粒子直径在1nm~100nm之间 | |
| B. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 光束通过胶体时有丁达尔效应 |
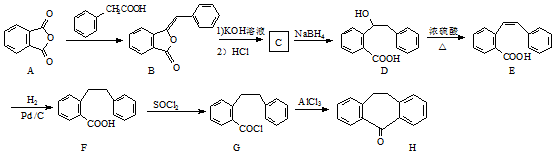
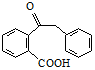 .
.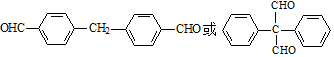 .
.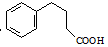 为原料制备
为原料制备 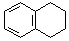 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).