题目内容
11.铁氧体可用于隐形飞机上吸收雷达波涂料.一种以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下:
(1)当x=0.4,试用氧化物形式表示该铁氧体组成2MnO•3ZnO•5Fe2O3.
(2)酸浸时,二氧化锰被还原的化学方程式为:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O.
(3)活性铁粉除汞时,铁粉的作用是还原剂(选填:氧化剂、还原剂、吸附剂).
(4)煮沸1h是为了使H2O2分解.
(5)同时加入MnSO4和铁粉的目的是调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成.
分析 废电池酸浸得到滤液中液中主要金属阳离子有Mn2+、Hg2+、Zn2+,加入铁粉除Hg,吹出汞蒸汽经KMnO4溶液吸收,除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰等,加入MnSO4和铁粉,调节滤液离子的成分,煮沸除去双氧水,再水热,进行后处理,也能得到锰锌铁氧体,
(1)Mn为+2价、Zn为+2价,利用化合价代数和为0,计算Fe元素化合价,再结合Mg、Zn、Fe原子数目之比改写为氧化物形式;
(2)酸浸时,双氧水被氧化生成氧气,二氧化锰还原生成硫酸锰,反应还有水生成;
(3)利用铁粉把Hg还原出来;
(4)双氧水受热会分解,据此答题;
(5)除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰、硫酸等,不加入MnSO4和铁粉,进行后续操作,也能得到锰锌铁氧体,而实际中加入需加入一定量的MnSO4和铁粉,应是调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成.
解答 解:废电池酸浸得到滤液中液中主要金属阳离子有Mn2+、Hg2+、Zn2+,加入铁粉除Hg,吹出汞蒸汽经KMnO4溶液吸收,除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰等,加入MnSO4和铁粉,调节滤液离子的成分,煮沸除去双氧水,再水热,进行后处理,也能得到锰锌铁氧体,
(1)Mn为+2价、Zn为+2价,当x=0.4时,利用化合价代数和为0,可知Fe元素化合价为+3,改写为氧化物形式为:2MnO•3ZnO•5Fe2O3,
故答案为:2MnO•3ZnO•5Fe2O3;
(2)酸浸时,双氧水被氧化生成氧气,二氧化锰还原生成硫酸锰,反应还有水生成,反应方程式为:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O,
故答案为:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O;
(3)铁粉具有还原性,能把汞离子还原为汞单质,所以铁粉的作用是还原剂,
故答案为:还原剂;
(4)煮沸1h是为了使双氧水受热会分解,
故答案为:H2O2;
(5)除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰、硫酸等,不加入MnSO4和铁粉,进行后续操作,也能得到锰锌铁氧体,而实际中加入需加入一定量的MnSO4和铁粉,应是调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成,
故答案为:调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成.
点评 本题考查化学工艺流程、物质的分离提纯、对操作的分析评价、读图获取信息能力等,侧重考查学生对知识的迁移运用,难度中等.

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | b>f | |
| B. | 平衡常数K(1000℃)<K(810℃) | |
| C. | 915℃,2.0MPa该反应的平衡常数为Kp=4.5MPa | |
| D. | 1000℃,3.0MPa时E的转化率为83% |
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).
某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).若某一时刻,容器中有1.2molC、1.2molNO、0.75molN2和1.08molCO2,此时v(正)=v(逆)(填“>、<、=”)
③下列各项能判断该反应达到平衡状态的是AC(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
④一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
(2)将水蒸气通过红热的碳即可产生水煤气.已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H=-41.2kJ•mol-1.
(3)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)?H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
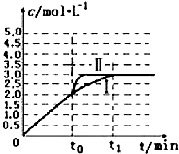
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线.
| A. | 加成反应 | B. | 氧化反应 | C. | 水解反应 | D. | 缩聚反应 |
| A. | 当金属全部溶解时收集到NO气体的体积一定为2.24 L | |
| B. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL | |
| C. | 参加反应的金属的总质量3.6g<m<9.6 g | |
| D. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |


