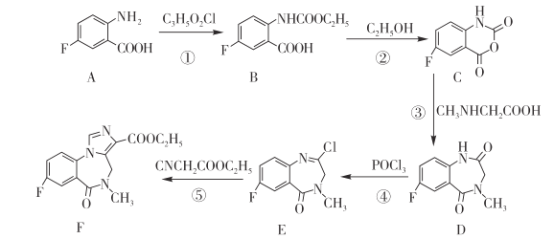
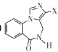
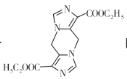
题目内容
【题目】下列实验的现象和结论都正确的是
实验 | 现象 | 结论 |
A.充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不能燃烧 | Na2SiO3可做防火剂 |
B.测定浓度均为0.1 mol·L-1的CH3COONa与HCOONa溶液的pH | CH3COONa溶液的pH较大 | 结合H+的能力: HCOO->CH3COO- |
C.某溶液中加浓NaOH溶液加热 | 产生能使湿润的蓝色石蕊试纸变红色的气体 | 原溶液中有 |
D.将SO2通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2具有漂白性 |
A.AB.BC.CD.D
【答案】A
【解析】
A.浸泡了Na2SiO3饱和溶液的小木条,沥干后在酒精灯外焰加热,小木条不能燃烧,表明Na2SiO3能阻止小木条的燃烧,说明Na2SiO3熔点高,比较稳定,具有防火能力,可作防火剂,A正确;
B.根据“越弱越水解”的规律分析,浓度均为0.1 mol·L-1的CH3COONa与HCOONa溶液,前者的pH大,表明前者的水解能力强,则结合H+的能力CH3COO->HCOO-,B不正确;
C.某溶液中加浓NaOH溶液加热,产生能使湿润的红色石蕊试纸变蓝色的气体,则表明原溶液中有![]() ,C不正确;
,C不正确;
D.将SO2通入酸性高锰酸钾溶液中,溶液褪色,表明SO2具有还原性,而不是漂白性,D不正确;
故选A。

练习册系列答案
相关题目