题目内容
20.铁是人类较早使用的金属之一.运用所学知识,回答下列问题.(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是用平行光照射两种分散系(或丁达尔现象).
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:Cu+2Fe3+=Cu2++2Fe2+.
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则反应的离子方程式Fe3++SCN-=Fe(SCN)3;
②验证该溶液中含有Fe2+,正确的实验方法是B.
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)现有一含有FeCl2和FeCl3的混合物样品,经试验方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为10%.
分析 (1)根据鉴别溶液和胶体的最简单的方法是丁达尔现象,胶体具有丁达尔现象,而溶液不具有,以此来解答;
(2)铜与氯化铁反应生成氯化铜、氯化亚铁;
(3)①三价铁遇硫氰酸钾显红色,Fe3++SCN-=Fe(SCN)3;
②检验的Fe2+方法;
(4)根据元素守恒计算氯化亚铁和氯化铁物质的量之比,进而计算氯化铁质量分数.
解答 解:(1)因FeCl3溶液是溶液,无丁达尔现象,而Fe(OH)3胶体是胶体,有丁达尔现象,所以鉴别FeCl3溶液和Fe(OH)3胶体中最简单有效的是观察是否产生了丁达尔现象(效应),故答案为:用平行光照射两种分散系(或丁达尔现象);
(2)铜与氯化铁反应生成氯化铜、氯化亚铁,反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,
故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(3)①三价铁遇硫氰酸钾显红色,Fe3++SCN-=Fe(SCN)3,故答案为:Fe3++SCN-=Fe(SCN)3;
②A、观察溶液是否呈浅绿色,不能证明,故A错误;
B、向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+;故B正确;
C、试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+,应该是先加入硫氰化钾,不变色,再加入氯水,若显示红色,证明有亚铁离子,故C错误;
故选B;
(4)设混合物中FeCl2物质的量为x,FeCl3的物质的量为y,则$\frac{x+y}{2x+3y}=\frac{1}{2.1}$,得到x:y=9:1,氯化铁物质的量分数=$\frac{1}{1+9}$×100%=10%;
故答案为:10%.
点评 本题考查了铁及其化合物的性质,涉及的内容较多,注意分析题中提供的信息,根据所学知识写成反应的方程式,本题难度中等.

| A. | Q1+Q2>Q3 | B. | Q1+Q2<Q3 | C. | Q1+Q2>2Q3 | D. | Q1+Q2<2Q3 |
| A. | NO | B. | Cu2S | C. | FeCl3 | D. | FeCl2 |
| 实验操作 | 实验目的 | |
| A | C2H4与C2H6混合气体通过盛有酸性KMnO4的洗气瓶 | 除去C2H6中的C2H4 |
| B | 制溴苯时用Fe | 加快化学反应速率 |
| C | 淀粉溶液水解后冷却至室温,加碘水观察现象 | 检验淀粉是否完全水解 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,先加稀硝酸,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A. | A | B. | B | C. | C | D. | D |
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8 kJ/mol | |
| B. | 2SO2+O2?2SO3;△H=-196.6 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l);△H=-571.6 kJ | |
| D. | C(s)+O2(g)═CO2(g);△H=+393.5 kJ/mol |
| A. | 甲烷在空气中点燃 | |
| B. | 乙烯通入溴的四氯化碳溶液 | |
| C. | 在鎳做催化剂的条件下,苯与氢气反应 | |
| D. | 苯与液溴混合后撒入铁粉 |
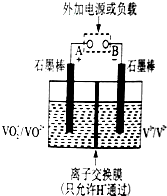 钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用.回答下列问题:
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用.回答下列问题: