题目内容
14.纯碱与稀盐酸起反应,在标准状况下生成11.2LCO2气体,计算:(1)反应消耗纯碱的物质的量.
(2)需要1mol/L的稀盐酸的体积.
分析 纯碱与稀盐酸起反应,在标准状况下生成11.2LCO2气体,物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,根据反应方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑,进行计算求解.
解答 解:(1)设反应消耗纯碱的物质的量为xmol,
则Na2CO3+2HCl═2NaCl+H2O+CO2↑
1mol 2mol 1mol
xmol 1mol 0.5mol
则:$\frac{1mol}{xmol}=\frac{1mol}{0.5mol}$,解之得:x=0.5mol;
答:反应消耗纯碱的物质的量为:0.5mol;
(2)由(1)可知:氯化氢的物质的量为:1mol,V=$\frac{1mol}{1mol/L}$=1L,
答:需要1mol/L的稀盐酸的体积为1L.
点评 本题考查化学方程式的相关计算,题目难度不大,注意方程式的书写以及相关物理量的计算.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
14.下列变化中,属于加成反应的是( )
| A. | 乙烯使酸性KMnO4溶液褪色的反应 | B. | 甲烷与氯气在光照条件下的反应 | ||
| C. | 乙烯使溴水褪色的反应 | D. | 乙烯的燃烧反应 |
5.下列说法正确的是( )
| A. | 由不同原子组成的纯净物一定是化合物 | |
| B. | 一定温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,则该气体中每个分子含有2个原子 | |
| C. | 含金属元素的离子一定都是阳离子 | |
| D. | 胆矾是混净物,水泥是混合物 |
2.在H2O、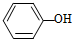
 、CH 3COOH、HCl的排列中,
、CH 3COOH、HCl的排列中, 应填入的物质是( )
应填入的物质是( )

 、CH 3COOH、HCl的排列中,
、CH 3COOH、HCl的排列中, 应填入的物质是( )
应填入的物质是( )| A. | H2SO4 | B. | CH3CH2OH | C. | H2CO3 | D. | CH3COOCH3 |
9.如表给出了各个化学键的键能数据:
下列分子中,最稳定的是( )
| 化学键 | H-H | H-Cl | H-I | Cl-Cl | Br-Br |
| 键能/kj•mol-1 | 436 | 431 | 299 | 243 | 194 |
| A. | Cl2 | B. | Br2 | C. | HCl | D. | H2 |
19.将淀粉加入试管里,加适量的水,振荡,加热煮沸,取所得溶液3mL,加1mL 稀硫酸溶液,加热一分钟,冷却后加入新制的Cu(OH)2悬浊液,加热后未见红色沉淀,其原因是( )
| A. | 加入Cu(OH)2浊液之前,未用NaOH溶液中和硫酸 | |
| B. | 制Cu(OH)2时,硫酸铜溶液太稀,NaOH过量了 | |
| C. | 加热时间不充分,淀粉没有充分水解 | |
| D. | 所用淀粉浓度不够 |
6.合成导电高分子材料PPV的反应:
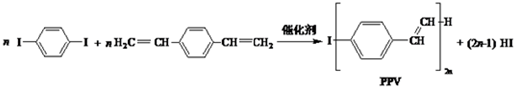
下列说法正确的是( )

下列说法正确的是( )
| A. | 合成PPV的反应为缩聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. | 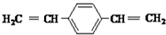 和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过红外光谱测定PPV的平均相对分子质量,可得其聚合度 |
3.下列结论均出自《实验化学》中的实验,其中错误的是( )
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 蒸馏操作时,温度计水银球的位置应在蒸馏烧瓶的支管口处 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
