题目内容
武穴市拥有较丰富的大理石矿产资源,但原生矿的纯度较低.武穴大理石含有的杂质主要是Fe2O3、Al2O3、SiO2.以下是某化学兴趣小组设计的制取纯净CaCO3粉末的实验步骤(假设每步反应均完全进行),请回答下列问题:

(1)写出武穴大理石与硝酸反应的离子方程式(任写一个) .
(2)固体残渣A的化学式为 .
(3)试剂B的作用是使滤液A中的Fe3+、Al3+尽可能沉淀完全,则试剂B可以是 .
A.NaOH溶液 B.稀氨水 C.NaHCO3溶液 D.Na2CO3溶液
(4)检验滤液B中是否含有Fe3+的方法是 .
(5)滤液C的主要溶质的化学式为 .

(1)写出武穴大理石与硝酸反应的离子方程式(任写一个)
(2)固体残渣A的化学式为
(3)试剂B的作用是使滤液A中的Fe3+、Al3+尽可能沉淀完全,则试剂B可以是
A.NaOH溶液 B.稀氨水 C.NaHCO3溶液 D.Na2CO3溶液
(4)检验滤液B中是否含有Fe3+的方法是
(5)滤液C的主要溶质的化学式为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:武穴大理石用足量的硝酸溶解,发生反应为CaCO3+2H+=Ca2++H2O+CO2↑,Fe2O3+6H+=2Fe3++3H2O,Al2O3+6H+=2Al3++3H2O,过滤除去固体残渣A为二氧化硅,则滤液A含有钙离子、铁离子、铝离子,加入足量的试剂B即成弱碱性使铁离子、铝离子以氢氧化铁、氢氧化铝沉淀而除去,再加入适量的碳酸铵与溶液中的硝酸钙反应生成碳酸钙和硝酸铵,过滤得到碳酸钙,以此分析解答;
(1)根据以上分析,武穴大理石用足量的硝酸溶解,发生反应为CaCO3+2H+=Ca2++H2O+CO2↑,Fe2O3+6H+=2Fe3++3H2O,Al2O3+6H+=2Al3++3H2O;
(2)根据以上分析,固体残渣A的化学式为SiO2;
(3)试剂B的作用是使滤液A中的Fe3+、Al3+尽可能沉淀完全,根据氢氧化铝会继续与强碱反应,但不能使钙离子也沉淀分析;
(4)检验滤液B中是否含有Fe3+的方法是取少量滤液B,滴加KSCN溶液,若溶液呈血红色,则含有Fe3+,否则不含有Fe3+;
(5)根据以上分析,碳酸铵与溶液中的硝酸钙反应产物分析;
(1)根据以上分析,武穴大理石用足量的硝酸溶解,发生反应为CaCO3+2H+=Ca2++H2O+CO2↑,Fe2O3+6H+=2Fe3++3H2O,Al2O3+6H+=2Al3++3H2O;
(2)根据以上分析,固体残渣A的化学式为SiO2;
(3)试剂B的作用是使滤液A中的Fe3+、Al3+尽可能沉淀完全,根据氢氧化铝会继续与强碱反应,但不能使钙离子也沉淀分析;
(4)检验滤液B中是否含有Fe3+的方法是取少量滤液B,滴加KSCN溶液,若溶液呈血红色,则含有Fe3+,否则不含有Fe3+;
(5)根据以上分析,碳酸铵与溶液中的硝酸钙反应产物分析;
解答:
解:武穴大理石用足量的硝酸溶解,发生反应为CaCO3+2H+=Ca2++H2O+CO2↑,Fe2O3+6H+=2Fe3++3H2O,Al2O3+6H+=2Al3++3H2O,过滤除去固体残渣A为二氧化硅,则滤液A含有钙离子、铁离子、铝离子,加入足量的试剂B即成弱碱性使铁离子、铝离子以氢氧化铁、氢氧化铝沉淀而除去,再加入适量的碳酸铵与溶液中的硝酸钙反应生成碳酸钙和硝酸铵,过滤得到碳酸钙;
(1)根据以上分析,武穴大理石用足量的硝酸溶解,发生反应为CaCO3+2H+=Ca2++H2O+CO2↑,Fe2O3+6H+=2Fe3++3H2O,Al2O3+6H+=2Al3++3H2O,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑或Fe2O3+6H+=2Fe3++3H2O或Al2O3+6H+=2Al3++3H2O;
(2)根据以上分析,固体残渣A的化学式为SiO2;故答案为:SiO2;
(3)试剂B的作用是使滤液A中的Fe3+、Al3+尽可能沉淀完全,根据氢氧化铝会继续与强碱反应,所以试剂B呈弱碱性,但不能使钙离子也沉淀所以不选碳酸盐,故选:BC;
(4)检验滤液B中是否含有Fe3+的方法是取少量滤液B,滴加KSCN溶液,若溶液呈血红色,则含有Fe3+,否则不含有Fe3+;故答案为:取少量滤液B,滴加KSCN溶液,若溶液呈血红色,则含有Fe3+,否则不含有Fe3+;
(5)根据以上分析,滤液C的主要溶质的化学式为NH4NO3,故答案为:NH4NO3;
(1)根据以上分析,武穴大理石用足量的硝酸溶解,发生反应为CaCO3+2H+=Ca2++H2O+CO2↑,Fe2O3+6H+=2Fe3++3H2O,Al2O3+6H+=2Al3++3H2O,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑或Fe2O3+6H+=2Fe3++3H2O或Al2O3+6H+=2Al3++3H2O;
(2)根据以上分析,固体残渣A的化学式为SiO2;故答案为:SiO2;
(3)试剂B的作用是使滤液A中的Fe3+、Al3+尽可能沉淀完全,根据氢氧化铝会继续与强碱反应,所以试剂B呈弱碱性,但不能使钙离子也沉淀所以不选碳酸盐,故选:BC;
(4)检验滤液B中是否含有Fe3+的方法是取少量滤液B,滴加KSCN溶液,若溶液呈血红色,则含有Fe3+,否则不含有Fe3+;故答案为:取少量滤液B,滴加KSCN溶液,若溶液呈血红色,则含有Fe3+,否则不含有Fe3+;
(5)根据以上分析,滤液C的主要溶质的化学式为NH4NO3,故答案为:NH4NO3;
点评:本题考查了物质的分离、提纯的方法及基本操作的综合应用,为高频考点,把握流程中物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析、推断及实验能力的综合考查,题目难度不大.

练习册系列答案
相关题目
下列离子方程式中,正确的是( )
| A、Ca(OH)2浊液与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| B、稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ |
| C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D、大理石溶于醋酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O |
已知 .现有A、B、C、D、E、F六种有机物有如下转化,其中A的分子式为C4H8O3.下列判断正确的是( )
.现有A、B、C、D、E、F六种有机物有如下转化,其中A的分子式为C4H8O3.下列判断正确的是( )
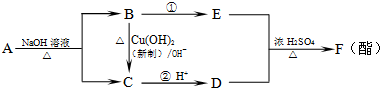
 .现有A、B、C、D、E、F六种有机物有如下转化,其中A的分子式为C4H8O3.下列判断正确的是( )
.现有A、B、C、D、E、F六种有机物有如下转化,其中A的分子式为C4H8O3.下列判断正确的是( )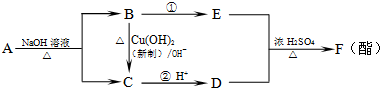
| A、有机物A结构可能有四种 |
| B、反应①属于氧化反应 |
| C、有机物B、D的最简式相同 |
| D、有机物E是交警检测酒驾的重要物证 |
某一有机物A可发生下列变化:已知C为羧酸,且C、E不发生银镜反应,则A的可能结构有( )


| A、1种 | B、3种 | C、2种 | D、1种 |



