题目内容
工业上用铝士矿(主要成分是Al2O3,还有少量Fe2O3、SiO2)提取、冶炼氧化
铝,然后电解氧化铝生产铝.其生产工艺流程如下图:
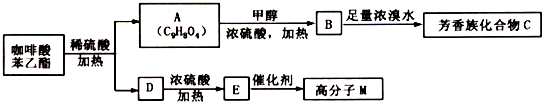
(1)原料A的名称是 .
(2)步骤①反应的离子方程式是 .
(3)滤液1中要加入稍过量原料B,原料B的化学式是 ,步骤②反应的离子方程式是 .
(4)步骤③反应的离子方程式是 .
铝,然后电解氧化铝生产铝.其生产工艺流程如下图:

(1)原料A的名称是
(2)步骤①反应的离子方程式是
(3)滤液1中要加入稍过量原料B,原料B的化学式是
(4)步骤③反应的离子方程式是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀.
由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2.
由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2.
解答:
解:由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2.
(1)由上述分析可知,步骤①加入盐酸,除去SiO2,所以原料A为盐酸,故答案为:盐酸;
(2)氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O;
(3)步骤①加入过量盐酸,滤液①中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,反应为Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓,故答案为:NaOH;Al3++4OH-=AlO2-+2H2O、)、Fe3++3OH-=Fe(OH)3↓;
(4)滤液②含有AlO2-,步骤③通入二氧化碳,与AlO2-反应生成的沉淀为氢氧化铝,反应离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
故答案为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
(1)由上述分析可知,步骤①加入盐酸,除去SiO2,所以原料A为盐酸,故答案为:盐酸;
(2)氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O;
(3)步骤①加入过量盐酸,滤液①中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,反应为Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓,故答案为:NaOH;Al3++4OH-=AlO2-+2H2O、)、Fe3++3OH-=Fe(OH)3↓;
(4)滤液②含有AlO2-,步骤③通入二氧化碳,与AlO2-反应生成的沉淀为氢氧化铝,反应离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
故答案为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
点评:本题以框图题形式考查铝的化合物的性质,难度中等,清楚冶炼铝工艺流程原理,是对知识迁移的综合运用.

练习册系列答案
相关题目
甲烷分子呈正四面体型,下列有关叙述不能说明甲烷分子为正四面体型的是( )
| A、甲烷分子中任意三个H原子都构成正三角形 |
| B、二氯甲烷无同分异构体 |
| C、甲烷分子中四个C-H键的键长、键能、键角都相等 |
| D、丙烷无同分异构体 |
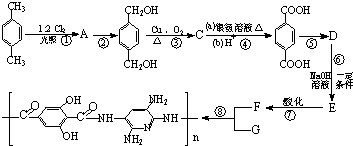


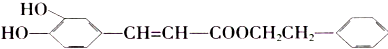 )是一种天然抗癌药物,在一定条件下发生如下转化:
)是一种天然抗癌药物,在一定条件下发生如下转化: