题目内容
A、B、C属于周期表前4周期的元素,它们的原子序数依次增大.A、B属于同一周期,C是生活中常见的金属元素.A的氧化物是沙子的主要成分,B的单质常温下为黄色粉末.
(1)C在周期表中位于 周期 族.
(2)在加热条件下B单质与C单质反应的化学方程式是 .
(3)A的氧化物用NaOH溶液处理,使A元素变为可溶性盐,该反应的离子方程式是 .
(4)B与C形成的化合物CB2,在有水存在的条件下用氧气氧化该化合物,得到强酸性溶液和低价盐,该氧化还原反应的化学方程式是 .
(1)C在周期表中位于
(2)在加热条件下B单质与C单质反应的化学方程式是
(3)A的氧化物用NaOH溶液处理,使A元素变为可溶性盐,该反应的离子方程式是
(4)B与C形成的化合物CB2,在有水存在的条件下用氧气氧化该化合物,得到强酸性溶液和低价盐,该氧化还原反应的化学方程式是
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C属于周期表前4周期的元素,它们的原子序数依次增大.A、B属于同一周期,C是生活中常见的金属元素,则C为铁元素;A的氧化物是沙子的主要成分,则A为硅元素;B的单质常温下为黄色粉末,则为硫元素,据此解答.
解答:
解:A、B、C属于周期表前4周期的元素,它们的原子序数依次增大.A、B属于同一周期,C是生活中常见的金属元素,则C为铁元素;A的氧化物是沙子的主要成分,则A为硅元素;B的单质常温下为黄色粉末,则为硫元素;据此解答.
(1)铁位于元素周期表的第四周期第ⅤⅢ族,故答案为:四;ⅤⅢ;
(2)在加热条件下,Fe与S反应生成FeS,反应为S+Fe
FeS,故答案为:S+Fe
FeS;
(3)SiO2与NaOH反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(4)FeS在有水存在的条件下用氧气氧化该化合物,得到强酸性溶液和低价盐,该氧化还原反应的化学方程式为2FeS2+7O2+2H2O=2H2SO4+2FeSO4,
故答案为:2FeS2+7O2+2H2O=2H2SO4+2FeSO4.
(1)铁位于元素周期表的第四周期第ⅤⅢ族,故答案为:四;ⅤⅢ;
(2)在加热条件下,Fe与S反应生成FeS,反应为S+Fe
| ||
| ||
(3)SiO2与NaOH反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(4)FeS在有水存在的条件下用氧气氧化该化合物,得到强酸性溶液和低价盐,该氧化还原反应的化学方程式为2FeS2+7O2+2H2O=2H2SO4+2FeSO4,
故答案为:2FeS2+7O2+2H2O=2H2SO4+2FeSO4.
点评:本题考查了根据元素在元素周期表中的位置及原子结构推断元素,难度不大.

练习册系列答案
相关题目
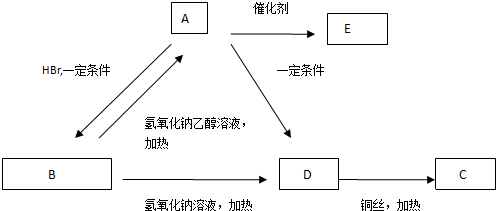


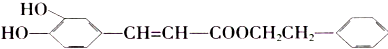 )是一种天然抗癌药物,在一定条件下发生如下转化:
)是一种天然抗癌药物,在一定条件下发生如下转化:
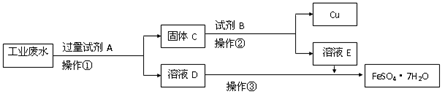 某工厂的酸性废水中含有大量的Fe3+、Cu2+、SO42-和少量Na+.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾.
某工厂的酸性废水中含有大量的Fe3+、Cu2+、SO42-和少量Na+.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾.