题目内容
1.下列事实对应的现象和解释均正确的是( )| 事实 | 现象 | 解释 | |
| A | 氯化铁溶液中滴加少量氢硫酸 | 产生黄色浑浊 | 2Fe3++H2S=2Fe2++S↓+2H+ |
| B | Fe(NO3)2溶液加稀盐酸 | 溶液绿色加深 | Fe2++H2O?Fe(OH)2+2H+ 抑制了水解,浅绿色加深 |
| C | 已知CH4的燃烧热为890kJ/mol | 甲烷用作燃料,1.6g CH4完全燃烧,放热89kJ | CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol |
| D | Mg(OH)2悬浊液中滴加FeCl3溶液至Mg(OH)2几乎完全反应 | 白色沉淀变为红褐色沉淀 | $\frac{{k}_{sp}^{3}[Mg(OH)_{2}]}{{k}_{sp}^{2}[Fe(OH]_{3}]}$<105 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化铁具有氧化性,可与硫化氢发生氧化还原反应;
B.硝酸根离子在酸性条件下具有强氧化性,可氧化亚铁离子;
C.根据燃烧热的定义判断;
D.溶度积未知,不能计算常数关系.
解答 解:A.氯化铁具有氧化性,可与硫化氢发生氧化还原反应,反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,有黄色沉淀生成,故A正确;
B.硝酸根离子在酸性条件下具有强氧化性,可氧化亚铁离子,反应后有铁离子生成,故B错误;
C.已知CH4的燃烧热为890kJ/mol,水应为液态,则燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,故C错误;
D.向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀,反应的离子方程式为:3Mg(OH)2+2Fe3+=2Fe(OH)3↓+3Mg2+,$\frac{{k}_{sp}^{3}[Mg(OH)_{2}]}{{k}_{sp}^{2}[Fe(OH]_{3}]}$为该反应的平衡常数,因溶度积未知,不能计算常数关系,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、燃烧热以及沉淀转化等,把握反应原理及物质的性质为解答的关键,注意方案的操作性、评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列说法不正确的是( )
| A. | 分类方法、统计方法、定量研究、实验方法和模型化方法是化学研究的常用方法 | |
| B. | “终极电池”锂-空气电池,它不可以直接采用无机盐水溶液为电解液 | |
| C. | 石墨烯(Graphene)是从石墨材料中剥离出来、由碳原子组成的单层原子面材料,它可以从C60、金刚石等物质中剥离出来 | |
| D. | ClO2是Al级高效安全灭菌消毒剂.它在水中的杀菌、消毒能力强,特效长,受水体的pH变化的影响小,难形成致癌氯代物 |
12.某化妆品的组分Z具有美白功效,可用如图反应制备,下列叙述不正确的是( )


| A. | 该反应属于加成反应 | |
| B. | X与Z均能与NaHCO3溶液反应放出CO2 | |
| C. | Y可作加聚反应单体,X可作缩聚反应单体 | |
| D. | 1mol Y发生加成反应最多可消耗4mol H2 |
9.下列说法正确的是( )
| A. | 碳酸钠可作为治疗胃溃疡病人的胃酸过多症的药物 | |
| B. | 为了提高铜粉与硝酸的反应速率,可向烧瓶中加入少量石墨或硝酸银浓溶液 | |
| C. | 向柠檬醛 中加入高锰酸钾性溶液,溶液褪色,说明柠檬醛分子中含有醛基 中加入高锰酸钾性溶液,溶液褪色,说明柠檬醛分子中含有醛基 | |
| D. |  名称为:1,3─二甲基─2─丁烯 名称为:1,3─二甲基─2─丁烯 |
16.下列解释亊实的化学用语正确的是( )
| A. | 利用乙烯为原料生成环氧乙烷:2CH2=CH2+02$\stackrel{Ag}{→}$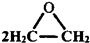 | |
| B. | 用铁氰化钾溶液检验 Fe2+:3Fe2++2[Fe(CN)6]3-=Fe2[Fe(CN)6]3↓ | |
| C. | NH4HS03溶液中加入足量的KOH溶液NH4++0H-=NH3•H2O | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+S02+H20=CaSO3↓+2HClO |
6.丹参素的结构简式为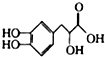 ,下列有关丹参素的说法不正确的是( )
,下列有关丹参素的说法不正确的是( )
 ,下列有关丹参素的说法不正确的是( )
,下列有关丹参素的说法不正确的是( )| A. | 分子式为C9H10O5 | B. | 能发生加成反应 | ||
| C. | 能与NaHCO3溶液反应 | D. | 能发生酯化反应和水解反应 |
13.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 0.1molNaHSO4固体中含有的阳离子数目为0.1NA | |
| B. | 常温常压下,3.2gN2H4中含有的极性共价键数目为0.1NA | |
| C. | 25℃时,pH=12的Ba(OH)2溶液中含OH-的数目为0.01NA | |
| D. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
10.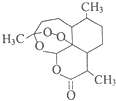 青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )
青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )
 青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )
青蒿素(结构简式如图)是一种白色针状固体,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”.中国女科学家屠呦呦凭借用乙醚从青蒿中提取青蒿素获得2015年诺贝尔医学奖.下列关于青蒿素的说法不正确的是( )| A. | 青蒿素分子中含有醚键和酯基等官能团 | |
| B. | 青蒿素在加热时能与NaOH的水溶液反应 | |
| C. | 青蒿素易溶于水、苯等溶剂 | |
| D. | 用乙醚从青蒿中提取青蒿素,用到了萃取原理 |
11.下列关于离子共存或离子反应的说法正确的是( )
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2 O2+2H+═2Fe3++2H2O | |
| D. | 稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+2H2O |