题目内容
3.下列实验操作或装置正确的是( )| A. |  点燃酒精灯 | B. |  蒸发浓缩 | ||
| C. |  蒸馏 | D. |  过滤 |
分析 A.酒精灯不能利用另一只酒精灯引燃,易失火;
B.蒸发浓缩在蒸发皿中进行;
C.冷水应下进上出,冷凝效果好;
D.过滤遵循一贴二低三靠.
解答 解:A.酒精灯不能利用另一只酒精灯引燃,易失火,应利用火柴点燃,故A错误;
B.蒸发浓缩在蒸发皿中进行,图中仪器选择不合理,故B错误;
C.冷水应下进上出,冷凝效果好,由图可知冷水方向不合理,故C错误;
D.过滤遵循一贴二低三靠,图中装置及仪器、操作均合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、实验操作、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
13.下列说法中不正确的是( )
| A. | 正戊烷、新戊烷、异戊烷互为同分异构体 | |
| B. | 扁桃酸( )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种 | |
| C. |  互为同系物 互为同系物 | |
| D. | 四氯乙烯分子中所有原子都处于同一平面 |
14.下列实验操作能达到预期实验目的是( )
| 实验目的 | 实验操作 | |
| A | 验证淀粉已水解 | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的银氨溶液并水浴加热 |
| B | 比较醋酸和次氯酸的酸性强弱 | 用PH试纸测定0.1mol•L-1醋酸钠溶液和0.01mol•L-1次氯酸钠溶液的PH |
| C | 证明Cl2的氧化性比Br2氧化性强 | 0.1mol•L-1 NaBr溶液中加入适量的新制氯水,反应后再加入适量的四氯化碳,振荡,观察下层液体的颜色 |
| D | 除去苯中混有的少量苯酚 | 向其中加入适量的溴水再过滤 |
| A. | A | B. | B | C. | C | D. | D |
11.下列实验操作中,不正确的是( )
| A. | 用量筒量取30mL溶液 | B. | 用四氯化碳萃取碘水中的碘 | ||
| C. | 用托盘天平称取2.5g固体 | D. | 用温度计代替玻璃棒搅拌溶液 |
18.常温下,下列物质与水混合后静置,出现分层的是( )
| A. | 苯 | B. | 乙醇 | C. | 乙酸 | D. | 氯化氢 |
8.小明的妈妈在超市购买了面粉、牛肉、桔子和梅子蜜饯,要求小明根据所学知识说出每种食品中所含的一类营养物质.下面是小明的回答,其中错误的是( )
| A. | 面粉-淀粉 | B. | 牛肉-蛋白质 | C. | 桔子-维生素 | D. | 梅子蜜饯-防腐剂 |
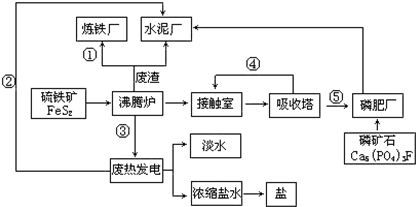
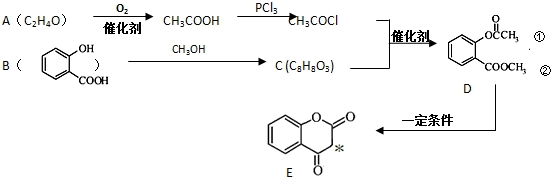
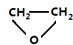 .
.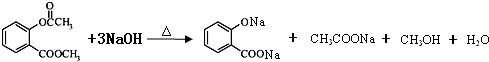 .
.