题目内容
某混合溶液中含氯化镁的浓度为2mol/L,含氯化铝的浓度为3mol/L,取此溶液200ml,为了使其中的Mg2+全部转化为Mg(OH)2沉淀分离出来,至少需要加1.6mol/L的氢氧化钠溶液的体积是( )
| A、3.2L |
| B、2 L |
| C、1.8 L |
| D、1.5 L |
考点:物质的量浓度的相关计算
专题:计算题
分析:根据MgCl2和AlCl3的混合溶液与氢氧化钠溶液的反应可知,要使Mg2+全部转化为沉淀分离出来,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,利用Na、Cl、Al原子守恒,有n(NaOH)=n(Cl)+n(Al),由此计算即可.
解答:
解:溶液中n(Cl)=0.2L×2mol/L×2+0.2L×3mol/L×3=2.6mol,
溶液中n(Al)=0.2L×3mol/L=0.6mol,
将200mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,
反应后溶液为NaCl、NaAlO2的混合液,
由原子守恒可知n(NaOH)=n(Na)=n(Cl)+n(Al)=2.6mol+0.6mol=3.2mol,
所以至少需要1.6mol/L氢氧化钠溶液的体积为
=2L,
故选B.
溶液中n(Al)=0.2L×3mol/L=0.6mol,
将200mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,
反应后溶液为NaCl、NaAlO2的混合液,
由原子守恒可知n(NaOH)=n(Na)=n(Cl)+n(Al)=2.6mol+0.6mol=3.2mol,
所以至少需要1.6mol/L氢氧化钠溶液的体积为
| 3.2ml |
| 1.6mol/L |
故选B.
点评:本题考查计算,利用原子守恒,简化解题,关键在于清楚反应后溶液为NaCl、NaAlO2的混合液.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于含Na元素、C1元素的物质的性质叙述正确的是( )
| A、Na单质在空气中缓慢氧化与燃烧的产物都是Na2O2 |
| B、Na2O与Na2O2都能与水反应,产物相同 |
| C、C12与H2混合光照爆炸,H2在C12也能平静的燃烧 |
| D、C12能与NaOH溶液反应,S单质与NaOH溶液加热也不反应 |
| E、C12能与NaOH溶液反应,S单质与NaOH溶液加热也不反应 |
下列说法中,正确的是( )
| A、元素周期表中的第ⅠA族元素全部是碱金属元素 |
| B、元素周期表中的第ⅦA族元素全部是非金属元素 |
| C、元素周期表中的0族元素最外层电子数都是8个 |
| D、元素周期表划分为7个周期18个族 |
下列化学用语表达正确的是( )
| A、甲烷的标准燃烧热△H=-890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ?mol-1 |
B、丙烯的键线式: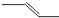 |
| C、一定条件下,某密闭容器中充入2mol SO2(g)和1molO2(g),达到平衡后,放出QkJ热量,则该条件下的热化学方程式为:2SO2(g)+O2(g)?2SO3(g )△H=-Q kJ?mol-1 |
| D、乙烯的结构简式:CH2CH2 |
在下面的价层电子构型中,第一电离能最小的原子是( )
| A、2s22p3 |
| B、3s23p5 |
| C、3s23p4 |
| D、3s23p6 |
某学生实验仪器的选择及数据记录,都合理的是( )
| A、酸碱中和滴定时,用10mL量筒量取10.00mL待测液 |
| B、用托盘天平称量25.20gNaCl固体 |
| C、常温条件下,用广泛pH试纸测得纯水的pH为7.0 |
| D、用500mL容量瓶配制480mL0.1000mol/LNaOH溶液 |
下列物理变化过程中,化学键被破坏的是( )
| A、碘升华 |
| B、冰融化成水 |
| C、蔗糖溶于水 |
| D、氯化钠晶体在熔化状态下电离 |
已知H2(g)+
O2(g)=H2O(g);△H=-241.8kJ/mol.下列说法中不正确的是( )
| 1 |
| 2 |
| A、H2的燃烧热为-241.8kJ |
| B、2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol |
| C、1molH2完全燃烧生成液态水放出的热量大于241.8kJ |
| D、断开1molH2O的化学键吸收的总能量大于断裂1molH2和0.5 molO2的化学键所吸收的总能量 |