题目内容
3.下列实验操作正确的是( )| A. | 将含硫酸的废液倒入水槽,用水冲入下水道 | |
| B. | 对医用酒精进行蒸馏操作可得到更高纯度的酒精溶液 | |
| C. | 加热高锰酸钾固体制取并收集氧气结束后,应立即停止加热 | |
| D. | 蒸馏实验时,冷水应从上口进下口出 |
分析 A.硫酸具有酸性,污染地下水和土壤;
B.蒸馏时能除去酒精中的杂质;
C.加热高锰酸钾固体制取并收集氧气结束后,应该先撤导管后停止加热;
D.蒸馏时,冷却水应该采用下口进上口出的原则.
解答 解:A.硫酸具有酸性,污染地下水和土壤,为防止污染地下水和土壤,应该处理后再倒入下水道,故A错误;
B.蒸馏时能除去酒精中的杂质,所以对医用酒精进行蒸馏操作可得到更高纯度的酒精溶液,故B正确;
C.加热高锰酸钾固体制取并收集氧气结束后,应该先撤导管后停止加热,否则易产生倒吸现象,故C错误;
D.蒸馏时,冷却水应该采用下口进上口出的原则,如果采用上口进下口出,蒸气急剧冷却会导致冷凝管炸裂,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及实验基本操作、实验安全等知识点,明确实验操作规范性是解本题关键,注意实验安全,杜绝安全事故发生.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
13. 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴盐酸后,溶液由黄色变为橙色,并半分钟内颜色不变为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
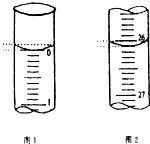
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0.00mL,终点读数为26.10mL;所用盐酸溶液的体积为26.10 mL.
(4)某学生根据三次实验分别记录有关数据如表:
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=0.1044mol/L(保留小数点后4位).
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴盐酸后,溶液由黄色变为橙色,并半分钟内颜色不变为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0.00mL,终点读数为26.10mL;所用盐酸溶液的体积为26.10 mL.
(4)某学生根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
11.碘是人体必需的微量元素之一.在市场中购买的加碘盐加入的是( )
| A. | I2 | B. | NaIO | C. | KI | D. | KIO3 |
18.在盛有饱和Na2CO3溶液的烧杯中,插入两个Pt电极,保持温度不变,通电一段时间后,下列判断正确的是( )
| A. | 溶液的pH将增大 | B. | Na+数和CO32-数的比值将变小 | ||
| C. | 溶液浓度不变,有晶体析出 | D. | 溶液浓度逐渐增大并有晶体析出 |
8.(1)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈紫红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(2)在100℃和200kPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
根据表中的数据,回答下列问题:
①压强从200kPa增加到500kPa时,平衡不移动(填“正向”“逆向”或“不”),理由是浓度增大的倍数和压强增大的倍数相同.
②压强从500kPa增加到1 000kPa时,平衡正向转移(填“正向”“逆向”或“不”),其原因可能是加压至1000kPa时,C物质变成了非气态物质.
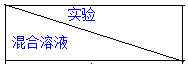 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈紫红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(2)在100℃和200kPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
| 压强(kPa) | 200 | 500 | 1 000 |
| B的浓度(mol•L-1) | 0.04 | 0.1 | 0.27 |
①压强从200kPa增加到500kPa时,平衡不移动(填“正向”“逆向”或“不”),理由是浓度增大的倍数和压强增大的倍数相同.
②压强从500kPa增加到1 000kPa时,平衡正向转移(填“正向”“逆向”或“不”),其原因可能是加压至1000kPa时,C物质变成了非气态物质.
15.某同学做如表实验:下列说法正确的是( )
| 装 置 | 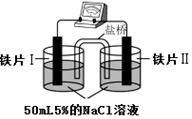 | 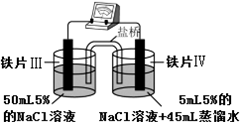 |
| 现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
| A. | “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 | |
| B. | 铁片Ⅳ的电极反应式可能为Fe-3e-=Fe3+ | |
| C. | 用K3Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断装置的正、负极 | |
| D. | 铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,所以二者的腐蚀速率相等 |
12.下列物质属于硅酸盐的是( )
| A. | 二氧化硅 | B. | 保鲜膜 | C. | 青花瓷 | D. | 金刚石 |
 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验: