题目内容
2.100mL 0.3mol•L-1 Na2SO4溶液和50mL 0.2mol•L-1 Al2(SO4)3溶液混合后(混合后溶液体积变化忽略不计),溶液中SO${\;}_{4}^{2-}$的物质的量浓度为( )| A. | 0.40mol•L-1 | B. | 0.50mol•L-1 | C. | 0.20 mol•L-1 | D. | 0.25 mol•L-1 |
分析 分别根据n=cV计算出硫酸钠、硫酸铝的物质的量,混合过程中硫酸根离子的物质的量不变,据此计算出混合液中硫酸根离子的物质的量,最后根据c=$\frac{n}{V}$计算出溶液中硫酸根离子的浓度.
解答 解:100mL 0.3mol•L-1 Na2SO4溶液中含有硫酸钠的物质的量为:0.3mol/L×0.1L=0.03mol,
50mL 0.2mol•L-1 Al2(SO4)3溶液中含有硫酸铝的物质的量为:0.2mol/L×0.05L=0.01mol,
则混合液中含有硫酸根离子的总物质的量为:0.03mol+0.01mol×3=0.06mol,
则混合液中硫酸根离子的物质的量浓度为$\frac{0.06mol}{0.1L+0.05L}$=0.4mol/L,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的表达式为解答关键,注意掌握溶质与含有离子的浓度之间的转化关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是( )
| A. | 阿司匹林(乙酰水杨酸) | B. | 青霉素 | ||
| C. | 抗酸药(氢氧化铝) | D. | 麻黄碱 |
17.化学在人类社会发展中起着重要的作用,展望未来,化学科学具有十分广阔的探索空间,下列四个选项中不正确的是( )
| A. | 塑料降解技术与化学科学无关 | |
| B. | 新能源--可燃冰的利用与化学关系密切 | |
| C. | 在垃圾处理、污水治理等方面化学科学将大有作为 | |
| D. | 随着化学科学的发展,合成橡胶的品种将越来越多 |
7.在溶液中能大量共存而且为无色透明的溶液是( )
| A. | NH4+、Cu2+、SO42-、NO3- | B. | K+、Ca2+、NO3-、CO32- | ||
| C. | Na+、K+、HCO3-、NO3- | D. | K+、MnO4-、NH4+、NO3- |
14.下列操作或发生事故时的处理方法正确的是( )
| A. | 将pH试纸用蒸馏水润湿后,测定稀盐酸的pH值 | |
| B. | 给试管里的液体加热时,试管应与桌面垂直 | |
| C. | 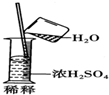 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%~5%的小苏打溶液 |
11.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.
供选择的化学试剂及实验方法
A.加热
B.滴加碘水
C.加入KSCN溶液
D.通过灼热的CuO.
| 实验目的 | 试剂及方法 |
| 证明地瓜中有淀粉 | B |
| 除去CO2中混有的少量CO | D |
| 检验FeCl2溶液是否变质 | C |
| 除去Na2CO3固体中NaHCO3 | A |
A.加热
B.滴加碘水
C.加入KSCN溶液
D.通过灼热的CuO.
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的质量之比为4:3,完全反应需要的时间之比为2:3.
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的质量之比为4:3,完全反应需要的时间之比为2:3. ; ③2-甲基-1-戊烯的键线式
; ③2-甲基-1-戊烯的键线式 .
.