题目内容
14.下列操作或发生事故时的处理方法正确的是( )| A. | 将pH试纸用蒸馏水润湿后,测定稀盐酸的pH值 | |
| B. | 给试管里的液体加热时,试管应与桌面垂直 | |
| C. | 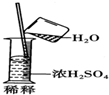 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%~5%的小苏打溶液 |
分析 A.pH试纸不能用蒸馏水润湿;
B.给试管里的液体加热时,试管应与桌面呈45℃角;
C.应将浓硫酸倒入水中;
D.因浓硫酸能与水反应会发热,如果用水清洗会增大烧伤面积,则先用抹布擦拭,再用大量的水冲洗,冲洗后皮肤上呈弱酸性,一般用弱碱性溶液来处理.
解答 解:A.pH试纸不能用蒸馏水润湿,否则相当于将待测液稀释了,故A错误;
B.给试管里的液体加热时,试管应与桌面呈45℃角,故B错误;
C.稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;切不可把水注入浓硫酸中,故C错误;
D.因浓硫酸能与水反应会发热,如果用水清洗会增大烧伤面积,则先用抹布擦拭,再用大量的水冲洗,冲洗后皮肤上呈弱酸性,涂上3%~5%的小苏打溶液,故D正确.
故选D.
点评 本题考查实验安全及事故处理,具备基本的化学实验技能是学习化学和进行化学探究活动的基础和保证,只有掌握化学实验的基本技能,才能安全、准确地进行化学实验,题目难度不大.

练习册系列答案
相关题目
4.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的物质的量比乙的物质的量小 | |
| C. | 甲的气体摩尔体积比乙的气体摩尔体积小 | |
| D. | 甲的相对分子质量比乙的相对分子质量小 |
5.工业电解饱和食盐水,要精制盐水以除去Ca2+、Mg2+、SO42-,下列依次加入试剂的顺序不正确的是( )
| A. | NaOH、BaCl2、Na2CO3、HCl | B. | Na2CO3、NaOH、BaCl2、HCl | ||
| C. | BaCl2、Na2CO3、NaOH、HCl | D. | BaCl2、NaOH、Na2CO3、HCl |
2.100mL 0.3mol•L-1 Na2SO4溶液和50mL 0.2mol•L-1 Al2(SO4)3溶液混合后(混合后溶液体积变化忽略不计),溶液中SO${\;}_{4}^{2-}$的物质的量浓度为( )
| A. | 0.40mol•L-1 | B. | 0.50mol•L-1 | C. | 0.20 mol•L-1 | D. | 0.25 mol•L-1 |
9.下列说法正确的是( )
①标准状况下,6.02×1023个分子所占的体积约是22.4L
②0.5mol H2所占体积为11.2L
③2L0.5mol/L亚硫酸溶液中含有的H+离子数为2NA
④标准状况下,28g CO与N2的混合气体的体积约为22.4L
⑤各种气体的气体摩尔体积都约为22.4L•mol-1
⑥标准状况下,体积相同的气体的分子数相同.
①标准状况下,6.02×1023个分子所占的体积约是22.4L
②0.5mol H2所占体积为11.2L
③2L0.5mol/L亚硫酸溶液中含有的H+离子数为2NA
④标准状况下,28g CO与N2的混合气体的体积约为22.4L
⑤各种气体的气体摩尔体积都约为22.4L•mol-1
⑥标准状况下,体积相同的气体的分子数相同.
| A. | ④⑥ | B. | ①③⑤ | C. | ③④⑥ | D. | ①④⑥ |
19.下列对人体健康无害的是( )
| A. | 用工业石蜡给瓜子美容 | B. | 用工业酒精(含甲醇)配兑饮用酒 | ||
| C. | 食用加碘盐预防碘缺乏病 | D. | 食用亚硝酸盐超标的腊肉 |
6.四个体积相同的密闭容器中,在一定条件下,发生如下反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,化学反应速率最小的是( )
| 容器 | 温度(℃) | N2(mol) | H2(mol) | 催化剂 |
| A | 500 | 1 | 3 | 有 |
| B | 500 | 0.5 | 1.5 | 有 |
| C | 450 | 1 | 3 | 无 |
| D | 450 | 0.5 | 1.5 | 无 |
| A. | A | B. | B | C. | C | D. | D |
3.有下列六种转化途径,某些反应条件和产物已略去,下列说法正确的是( )
途径①Fe$\stackrel{稀HCl}{→}$FeCl2溶液
途径②Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe,水}{→}$FeCl${\;}_{{\;}_{2}}$溶液
途径③Cl2$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液
途径④Cl2$\stackrel{NaOH溶液}{→}$NaClO溶液$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液
途径⑤S$\stackrel{浓HNO_{3}}{→}$H2SO4
途径⑥S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$$\stackrel{H_{2}O}{→}$H2SO4.
途径①Fe$\stackrel{稀HCl}{→}$FeCl2溶液
途径②Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe,水}{→}$FeCl${\;}_{{\;}_{2}}$溶液
途径③Cl2$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液
途径④Cl2$\stackrel{NaOH溶液}{→}$NaClO溶液$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液
途径⑤S$\stackrel{浓HNO_{3}}{→}$H2SO4
途径⑥S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$$\stackrel{H_{2}O}{→}$H2SO4.
| A. | 由途径①和②分别制取1mol FeCl2,理论各消耗1mol Fe,各转移2mol e- | |
| B. | 由途径③和④分别制取1mol Na2SO4,理论各消耗1mol Cl2,各转移2mol e- | |
| C. | 由途径⑤和⑥分别制取1mol H2SO4,理论各消耗1mol S,各转移6 mol e- | |
| D. | 以上说法都不正确 |