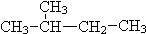题目内容
下列关于元素周期表的说法正确的是( )
| A、元素的性质随着原子的相对质量的递增而呈周期性变化的规律叫做元素周期律 |
| B、X2+的核外电子数目为18,则X在第三周期第ⅥA族 |
| C、因K比Na容易失去电子,所以金属性K比Na强 |
| D、Li、Na、K元素的原子随着核电荷数的增加核外电子层数减少 |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:A、结构决定性质,元素周期律的实质是元素的性质随着元素核电荷数的递增而呈周期性变化;
B、原子失电子形成阳离子,阳离子的核外电子数=质子数-所带电荷数,确定质子数,判断在周期表中位置;
C、元素失电子能力越强,元素的金属性越强;
D、同主族元素最外层电子数相同,电子层数不同,核电荷数越多电子层数越多.
B、原子失电子形成阳离子,阳离子的核外电子数=质子数-所带电荷数,确定质子数,判断在周期表中位置;
C、元素失电子能力越强,元素的金属性越强;
D、同主族元素最外层电子数相同,电子层数不同,核电荷数越多电子层数越多.
解答:
解:A、元素周期律指元素的性质随着元素的原子序数(即原子核外电子数或核电荷数)的增加呈周期性变化的规律,故A错误;
B、X2+的核外电子数目为18,所以质子数为18+2=20,为钙元素,位于第四周期第ⅡA族,故B错误;
C、根据元素失电子能力越强,元素的金属性越强,因为K比Na容易失去电子,所以金属性K比Na强,故C正确;
D、Li、Na、K元素的原子随着核电荷数的增加,核外电子层数增多,故D错误;
故选:C.
B、X2+的核外电子数目为18,所以质子数为18+2=20,为钙元素,位于第四周期第ⅡA族,故B错误;
C、根据元素失电子能力越强,元素的金属性越强,因为K比Na容易失去电子,所以金属性K比Na强,故C正确;
D、Li、Na、K元素的原子随着核电荷数的增加,核外电子层数增多,故D错误;
故选:C.
点评:本题考查元素周期表与元素周期律,难度不大,注意掌握元素周期表中的特殊性及元素周期律.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8g CH4含有4NA个氢原子 |
| B、1L 0.1 mol?L-1 (NH4)2SO4溶液中含有0.2NA个NH4+ |
| C、1mol Cu与足量FeCl3溶液反应,转移2NA个电子 |
| D、标准状况下,2.24L氮气含有0.1NA个N2分子 |
除第1周期外,关于同周期主族元素的下列变化规律中正确的是( )
| A、从左到右,原子半径逐渐增大 |
| B、从左到右,元素原子氧化性减弱,还原性增强 |
| C、从左到右,元素最高正价从+1递增到+7(O,P除外),负价由-4递变到-1 |
| D、从左到右,元素最高价氧化物对应的水化物的碱性增强,酸性减弱(O,F除外) |
下列有关电化学装置的叙述正确的是( )
A、 Zn、MnO2干电池放电时MnO2被氧化 Zn、MnO2干电池放电时MnO2被氧化 |
B、 电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等 电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等 |
C、 K分别于M、N连接,均可保护Fe电极,且都称为“牺牲阳极的阴极保护法” K分别于M、N连接,均可保护Fe电极,且都称为“牺牲阳极的阴极保护法” |
D、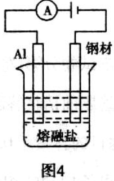 在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl3-,形式存在,则阳极反应式为:Al-3e-+7AlCl4-=4Al2Cl3- 在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl3-,形式存在,则阳极反应式为:Al-3e-+7AlCl4-=4Al2Cl3- |
下列鉴别物质的方法能达到目的是( )
| A、用氨水鉴别MgCl2溶液和AlCl3溶液 |
| B、用焰色反应鉴别Na2CO3固体和NaHCO3固体 |
| C、用BaCl2溶液鉴别AgNO3溶液和Na2SO4溶液 |
| D、用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 |

 和
和 ; ⑥
; ⑥ 和
和 ⑦CH3(CH2)3CH3和
⑦CH3(CH2)3CH3和