题目内容
2.Na2CO3和NaHCO3可作食用碱.下列用来解释事实的方程式中,不合理的是( )| A. | Na2CO3溶液可除油污:CO32-+H2O?HCO3-+OH- | |
| B. | NaHCO3可作发酵粉:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O | |
| C. | Na2CO3可用NaOH溶液吸收CO2制备:2OH-+CO2═CO32-+H2O | |
| D. | NaHCO3与食醋混用,产生CO2气体:HCO3-+H+═CO2↑+H2O |
分析 A.碳酸钠水解生成碳酸氢钠和氢氧化钠,溶液显碱性,油脂在碱性条件下水解生成可溶于水的物质;
B.碳酸氢钠不稳定,受热分解生成碳酸钠和水、二氧化碳;
C.二氧化碳为酸性氧化物,二氧化碳与过量氢氧化钠反应生成碳酸钠;
D.醋酸为弱酸,应保留化学式.
解答 解:A.碳酸钠水解生成碳酸氢钠和氢氧化钠,离子方程式CO32-+H2O?HCO3-+OH-,溶液显碱性,油脂在碱性条件下水解生成可溶于水的物质,故A正确;
B.碳酸氢钠不稳定,受热分解生成碳酸钠和水、二氧化碳:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O,所以可以做发酵粉,故B正确;
C.二氧化碳为酸性氧化物,二氧化碳与过量氢氧化钠反应生成碳酸钠,离子方程式:2OH-+CO2═CO32-+H2O,故C正确;
D.NaHCO3与食醋混用,产生CO2气体:HCO3-+CH3COOH═CO2↑+H2O+CH3COO-,故D错误;
故选:D.
点评 本题考查了化学方程式、离子方程式的书写,明确碳酸钠、碳酸氢钠的性质是解题关键,注意化学式的拆分,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
12.下列有水参加的反应中,不属于盐类水解反应的是( )
| A. | NH4++H2O?NH3•H2O+H+ | |
| B. | Al3++3H2O?Al(OH)3+3H+ | |
| C. | CH3COO-+NH4++H2O?CH3COOH+NH3•H2O | |
| D. | HCO3-+H2O?H3O++CO32- |
13.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| C. | 20ml 0.1mol/L CH3COONa溶液与10ml HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) |
10.某小组同学在实验室中研究+2和+3价铁的硝酸盐的化学性质.
(1)他们测硝酸亚铁溶液的pH常温下小于7,用离子方程式解释其原因是Fe2++2H2O?Fe(OH)2+2H+
(2)甲同学欲配制硝酸亚铁溶液,为防止水解,称量一定量硝酸亚铁晶体溶于pH=1的稀硝
酸中,溶液呈深棕色,液面上方有红棕色气体,放置一段时间,溶液最终呈黄色.
(已知:Fe2+能与NO结合形成深棕色的[Fe(NO)]2+:Fe2++NO?〔Fe(NO)]2+)
①液面上方红棕色气体是NO2
②经检验黄色溶液中有Fe3+.检验Fe3+的操作是取少量黄色溶液于试管中,滴入KSCN溶液,溶液显红色,证明含有Fe3+
③最初溶液中生成[Fe(NO)]2+使溶液呈深棕色,最终溶液变黄色的原因是在稀硝酸中Fe2+被NO3-氧化为Fe3+,使c(Fe2+)降低,Fe2++NO?〔Fe(NO)]2+的平衡向左移动,当Fe2+被完全氧化为Fe3+时,溶液由深棕色变为黄色
(3)甲同学继续用所得溶液进行实验.
①步骤i溶液中反应的离子方程式是2NO3-+3SO2+2H2O=3SO42-+2NO↑+4H+
②甲认为由步骤i的现象得出SO2与NO3-发生了反应,没有与Fe3+发生反应,请判断甲的结论是否正确并说明原因:正确.溶液上方产生红棕色的气体,说明NO3-被还原,溶液没有深棕色出现,说明Fe2+没有被氧化为Fe3+
③步骤ii溶液变为浅绿色,反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
④该实验得出的结论是SO2的还原性比Fe2+的强等
(1)他们测硝酸亚铁溶液的pH常温下小于7,用离子方程式解释其原因是Fe2++2H2O?Fe(OH)2+2H+
(2)甲同学欲配制硝酸亚铁溶液,为防止水解,称量一定量硝酸亚铁晶体溶于pH=1的稀硝
酸中,溶液呈深棕色,液面上方有红棕色气体,放置一段时间,溶液最终呈黄色.
(已知:Fe2+能与NO结合形成深棕色的[Fe(NO)]2+:Fe2++NO?〔Fe(NO)]2+)
①液面上方红棕色气体是NO2
②经检验黄色溶液中有Fe3+.检验Fe3+的操作是取少量黄色溶液于试管中,滴入KSCN溶液,溶液显红色,证明含有Fe3+
③最初溶液中生成[Fe(NO)]2+使溶液呈深棕色,最终溶液变黄色的原因是在稀硝酸中Fe2+被NO3-氧化为Fe3+,使c(Fe2+)降低,Fe2++NO?〔Fe(NO)]2+的平衡向左移动,当Fe2+被完全氧化为Fe3+时,溶液由深棕色变为黄色
(3)甲同学继续用所得溶液进行实验.
| 操作 | 步骤及现象 |
 | i:往溶液中缓慢通入SO2,液面上方有红棕色气体,溶液黄色无明显变化 ii:继续通入足量的SO2,溶液变为深棕色,一段时间后,溶液变为浅绿色 |
②甲认为由步骤i的现象得出SO2与NO3-发生了反应,没有与Fe3+发生反应,请判断甲的结论是否正确并说明原因:正确.溶液上方产生红棕色的气体,说明NO3-被还原,溶液没有深棕色出现,说明Fe2+没有被氧化为Fe3+
③步骤ii溶液变为浅绿色,反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
④该实验得出的结论是SO2的还原性比Fe2+的强等
7.化学与社会、生活密切相关,对下列常见无机物用途的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | Na可用于与TiCl4反应得3D打印飞机钛构件所需的原料Ti粉 | Na具有强还原性 |
| B | 明矾可用作净水 | 明矾能杀菌消毒 |
| C | SO2可用于漂白纸浆 | SO2具有强氧化性 |
| D | SiO2可用于制造光导纤维 | SiO2具有导电性 |
| A. | A | B. | B | C. | C | D. | D |
14. 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为N>O>C(用元素符号表示);试解释其原因同周期随原子序数增大第一电离能呈增大趋势,N元素2p轨道容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由大到下的顺序为N>O>C.
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2,B元素的最高价氧化物分子VSEPR模型为平面三角形,B元素与D元素形成分子空间构型为直线型.
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体.
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;后一现象的化学反应方程式为Cu(OH)2+4NH3=[Cu(NH3)4](OH)2.
(5)某同学根据上述信息,推断A基态原子的核外电子排布为: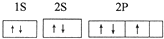
该同学所画的电子排布图违背了洪特规则.
(6)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不化简).
 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)B元素的低价氧化物分子中心原子的杂化方式为sp2,B元素的最高价氧化物分子VSEPR模型为平面三角形,B元素与D元素形成分子空间构型为直线型.
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点低(填“高”或“低”),其原因是晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体.
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;后一现象的化学反应方程式为Cu(OH)2+4NH3=[Cu(NH3)4](OH)2.
(5)某同学根据上述信息,推断A基态原子的核外电子排布为:

该同学所画的电子排布图违背了洪特规则.
(6)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为12,C晶体的密度为$\frac{16}{\sqrt{2}{r}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不化简).
11.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 活泼非金属单质在氧化还原反应中只作氧化剂 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 含有某元素最高价态的化合物不一定具有强氧化性 |


 .
. .
. 等.(任写一种)
等.(任写一种)