题目内容
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、2 L 1 mol?L-1的盐酸中所含氯化氢分子数为2NA |
| B、1L 0.1 mol?L-1的NaClO溶液中ClO-数目为0.1NA |
| C、标准状况下,11.2L乙醇完全燃烧生成的CO2分子数为NA |
| D、标准状况下,4.48 L N2所含的共用电子对数0.6NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氯化氢为强电解质,在水中完全电离;
B.次氯酸根离子为弱酸根离子,水溶液中部分水解;
C.气体摩尔体积适用对象为气体;
D.氮气分子中含有氮氮三键,1分子氮气中含有3个共用电子对;
B.次氯酸根离子为弱酸根离子,水溶液中部分水解;
C.气体摩尔体积适用对象为气体;
D.氮气分子中含有氮氮三键,1分子氮气中含有3个共用电子对;
解答:
解:A.氯化氢为强电解质,在水中完全电离,不存在氯化氢分子,故A错误;
B.次氯酸根离子为弱酸根离子,水溶液中部分水解,所以1L 0.1 mol?L-1的NaClO溶液中ClO-数目小于0.1NA,故B错误;
C.标况下,乙醇为液态,不能使用气体摩尔体积,故C错误;
D.标况下4.48L氮气的物质的量为0.2mol,0.2mol氮气中含有0.6mol共用电子对,所含的共用电子对数0.6NA,故D正确;
故选:D.
B.次氯酸根离子为弱酸根离子,水溶液中部分水解,所以1L 0.1 mol?L-1的NaClO溶液中ClO-数目小于0.1NA,故B错误;
C.标况下,乙醇为液态,不能使用气体摩尔体积,故C错误;
D.标况下4.48L氮气的物质的量为0.2mol,0.2mol氮气中含有0.6mol共用电子对,所含的共用电子对数0.6NA,故D正确;
故选:D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确氮气分子中存在氮氮三键是解题关键,注意气体摩尔体积使用对象和条件.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
下列有关反应热的叙述正确的是( )
| A、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| B、C(石墨,s)═C(金刚石,s)△H>0,所以金刚石比石墨稳定 |
| C、已知碳的燃烧热为ykJ/mol,当7.2g的碳在12.8g的氧气中燃烧,至反应物耗尽并放出xkJ的热量,则可求出1mol碳与氧气反应生成1mol一氧化碳气体时△H=-(2.5x-0.5y)kJ/mol |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
下列有关化学用语正确的是( )
A、NH4Cl的电子式: |
| B、含18个中子的氯原子的核素符号:1735Cl |
C、S2-的结构示意图: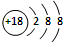 |
| D、次氯酸的结构式:H-O-Cl |
下列溶液中c(Cl-)与50mL 1mol/L AlCl3溶液中c(Cl-)相等是( )
| A、100mL 3mol/L KCl溶液 |
| B、25mL 2mol/L AlCl3溶液 |
| C、150mL 1mol/L NaCl溶液 |
| D、25mL 1.5mol/L MgCl2溶液 |
下列溶液中H+浓度为0.01mol/L的是( )
| A、0.01mol/L的CH3COOH |
| B、0.01mol/LNaHSO4 |
| C、0.01mol/LNaHCO3 |
| D、0.005mol/LH2SO3 |
分别取1g左右某脂肪酸(M<300):①与含I2为2.7g的碘的CCl4溶液完全加成;②与含0.2gKOH的溶液所中和.由此推测该脂肪酸的准确相对分子质量可能为( )
| A、290 | B、282 |
| C、280 | D、278 |
下列离子方程式书写正确的是( )
| A、赤铁矿投入到稀盐酸中:FeO+2H+═Fe2++H2O |
| B、FeCl3溶液中加入氢氧化钠溶液:Fe2++3OH-═Fe(OH)2↓ |
| C、三氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- |
 (1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是
(1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是