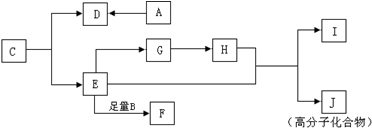
题目内容
中和某一强酸,需用一定量的KOH.
(1)改用和上述KOH等质量的Na2CO3,反应后溶液的pH 7;
(2)改用和上述KOH等质量的Ba(OH)2,反应后溶液中c(OH-) c(H+);
(3)改用和上述KOH等质量的NaOH,反应后溶液显 性;
(3)改用和上述KOH等物质的量的Ba(OH)2,反应后加入紫色石蕊试液,溶液显 色
(4)改用和上述KOH等物质的量的NaOH,反应后加入紫色石蕊试液,溶液显 色;
(5)改用和上述KOH等物质的量的NH3,反应后溶液显 性.
(1)改用和上述KOH等质量的Na2CO3,反应后溶液的pH
(2)改用和上述KOH等质量的Ba(OH)2,反应后溶液中c(OH-)
(3)改用和上述KOH等质量的NaOH,反应后溶液显
(3)改用和上述KOH等物质的量的Ba(OH)2,反应后加入紫色石蕊试液,溶液显
(4)改用和上述KOH等物质的量的NaOH,反应后加入紫色石蕊试液,溶液显
(5)改用和上述KOH等物质的量的NH3,反应后溶液显
考点:酸碱混合时的定性判断及有关ph的计算,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)设质量为m,根据二者与氢离子反应的关系式判断碳酸钠的过量情况,然后判断溶液的酸碱性;
(2)设质量为m,根据反应关系式判断氢氧化钡的过量情况,然后判断反应后溶液中c(OH-)、c(H+)的大小关系;
(3)氢氧化钠的摩尔质量小于氢氧化钾,二者都是一元强碱,则氢氧化钠过量,溶液显示碱性;
(3)Ba(OH)2为二元强碱,氢氧化钡过量,反应后的溶液显示碱性;
(4)改用和上述KOH等物质的量的NaOH,反应后溶液显示中性;
(5)改用和上述KOH等物质的量的NH3,氨气为弱碱,反应后生成强酸弱碱盐,溶液显示酸性.
(2)设质量为m,根据反应关系式判断氢氧化钡的过量情况,然后判断反应后溶液中c(OH-)、c(H+)的大小关系;
(3)氢氧化钠的摩尔质量小于氢氧化钾,二者都是一元强碱,则氢氧化钠过量,溶液显示碱性;
(3)Ba(OH)2为二元强碱,氢氧化钡过量,反应后的溶液显示碱性;
(4)改用和上述KOH等物质的量的NaOH,反应后溶液显示中性;
(5)改用和上述KOH等物质的量的NH3,氨气为弱碱,反应后生成强酸弱碱盐,溶液显示酸性.
解答:
解:(1)设质量为m,则氢氧化钾的物质的量为:
mol,氢氧化钾为一元强碱,则氢离子的物质的量为
mol;mg碳酸钠的物质的量为:
mol,
mol碳酸钠消耗氢离子的物质的量为:
mol×2=
mol>
mol,说明碳酸钠过量,反应后的溶液显示碱性,混合液的pH>7,
故答案为:>;
(2)设质量为m,则氢氧化钾的物质的量为:
mol,含有
mol氢氧根离子;mg氢氧化钡的物质的量为:
mol,含有的氢氧根离子为:
mol<
mol,氢氧根离子不足,混合液显示酸性,则c(OH-)<c(H+),
故答案为:<;
(3)改用和上述KOH等质量的NaOH,氢氧化钠的摩尔质量为:m(NaOH)=40g/mol<m(KOH)=56g/mol,根据n=
可知,质量相等时氢氧化钠的物质的量大于氢氧化钾,与该强酸反应后氢氧化钠过量,溶液显示碱性,
故答案为:碱;
(4)改用和上述KOH等物质的量的Ba(OH)2,氢氧化钡为二元强碱,与该酸混合后氢氧根离子过量,溶液显示碱性,加入紫色石蕊试液后显示蓝色,
故答案为:蓝;
(5)改用和上述KOH等物质的量的NaOH,氢氧根离子的物质的量相等,则氢氧化钠与酸恰好反应,反应后的溶液为中性,加入紫色石蕊试液后溶液为紫色,
故答案为:紫;
(6)氨气溶于水生成弱碱溶液,则改用和上述KOH等物质的量的NH3,反应生成强酸弱碱盐,铵根离子水解导致溶液显示酸性,
故答案为:酸.
| m |
| 56 |
| m |
| 56 |
| m |
| 106 |
| m |
| 106 |
| m |
| 106 |
| m |
| 53 |
| m |
| 56 |
故答案为:>;
(2)设质量为m,则氢氧化钾的物质的量为:
| m |
| 56 |
| m |
| 56 |
| m |
| 171 |
| m |
| 85.5 |
| m |
| 56 |
故答案为:<;
(3)改用和上述KOH等质量的NaOH,氢氧化钠的摩尔质量为:m(NaOH)=40g/mol<m(KOH)=56g/mol,根据n=
| m |
| M |
故答案为:碱;
(4)改用和上述KOH等物质的量的Ba(OH)2,氢氧化钡为二元强碱,与该酸混合后氢氧根离子过量,溶液显示碱性,加入紫色石蕊试液后显示蓝色,
故答案为:蓝;
(5)改用和上述KOH等物质的量的NaOH,氢氧根离子的物质的量相等,则氢氧化钠与酸恰好反应,反应后的溶液为中性,加入紫色石蕊试液后溶液为紫色,
故答案为:紫;
(6)氨气溶于水生成弱碱溶液,则改用和上述KOH等物质的量的NH3,反应生成强酸弱碱盐,铵根离子水解导致溶液显示酸性,
故答案为:酸.
点评:本题考查了酸碱混合的定性判断,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力灵活应用基础知识的能力,注意掌握溶液酸碱性的判断方法,明确溶液酸碱性与溶液pH的关系.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
将Fe、Cu、FeCl2、FeCl3、CuCl2盛于同一容器中充分反应,如Fe有剩余,则容器中只能有的金属或金属离子是( )
| A、Cu、Fe3+ |
| B、Fe2+、Fe3+ |
| C、Cu、Cu2+、Fe |
| D、Cu、Fe2+、Fe |
我们可以用水解度来表示盐水解程度的大小,它是用已水解的物质的量占原来总的电解质物质的量的分数来表示的.若测得2L 0.1mol/L的强碱弱酸盐NaA溶液的常温下的pH为10,则A-的水解度为( )
| A、0.01% | B、0.1% |
| C、0.2% | D、1% |
在pH=1的无色溶液中能大量共存的离子组是( )
| A、NH4+、Mg2+、SO42-、Cl- |
| B、Ba2+、K+、OH-、NO3- |
| C、Al3+、Cu2+、SO42-、Cl- |
| D、Na+、Ca2+、Cl-、CO32- |