题目内容
9.某工业含铜废料含有Cu、CuO、CuS、CuSO4等成分,利用该含铜废料可生产硝酸铜晶体[Cu(NO3)2•3H2O],其生产工艺流程如图所示:
回答下列问题:
(1)“焙烧”过程中生成SO2的化学方程式为2CuS+3O2$\frac{\underline{\;高温\;}}{\;}$2SO2+2CuO.
(2)“酸化”过程的离子方程式为CuO+2H+═Cu2++H2O.
(3)试剂a可以是铁粉.
(4)“淘洗”的目的是除去过量的铁粉,图中的淘洗液与滤液溶质的阴离子相同,則试剂b是稀硫酸,淘洗液的溶质是H2SO4和FeSO4.
(5)“反应”中使用20%硝酸和10% H2O2溶液,硝酸起酸的作用,则“反应”的化学方程式为Cu+H2O2+2HNO3═Cu(NO3)2+2H2O.若该步骤只使用20%硝酸,随着反应的进行,温度升高,出现大量红棕色气体,则生成红棕色气体时反应中还原剂与氧化剂的物质的量之比为1:2.
(6)“一系列操作”是指化学实验操作,这些操作需要用到的玻璃仪器有酒精灯、玻璃棒、烧杯、漏斗.
分析 铜废料含有Cu、CuO、CuS、CuSO4等成分,通入空气焙烧:2Cu+O2$\frac{\underline{\;高温\;}}{\;}$2CuO、2CuS+3O2$\frac{\underline{\;高温\;}}{\;}$2SO2+2CuO,废气为二氧化硫,再加入硫酸酸化浸取,得到硫酸铜溶液,向浸取液中加入铁粉,发生的离子反应为Cu2++Fe=Fe2++Cu,然后过滤得到的固体Cu,用稀硫酸淘洗铜除去过量的铁粉,然后加入20%硝酸和10% H2O2溶液,发生反应:Cu+H2O2+2HNO3═Cu( NO3)2+2H2O,将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到Cu(NO3)2•3H2O,据此分析解答.
解答 解:(1)“焙烧”过程中生成SO2的化学方程式为2CuS+3O2$\frac{\underline{\;高温\;}}{\;}$2SO2+2CuO;
故答案为:2CuS+3O2$\frac{\underline{\;高温\;}}{\;}$2SO2+2CuO;
(2)酸化过程为经过焙烧得到的氧化铜与稀硫酸反应生成铜离子,离子方程式为:CuO+2H+═Cu2++H2O;
故答案为:CuO+2H+═Cu2++H2O;
(3)试剂a将铜离子从溶液中置换出,可选用铁粉;
故答案为:铁粉;
(4)为了除去过量的铁粉,淘洗液与滤液溶质的阴离子相同,则试剂b选用稀硫酸,铁粉与稀硫酸反应生成硫酸亚铁离子,则淘洗液的溶质为H2SO4和FeSO4;
故答案为:除去过量的铁粉;稀硫酸;H2SO4和FeSO4;
(5)使用20%硝酸和10% H2O2溶液,硝酸起酸的作用,离子方程式为:Cu+H2O2+2HNO3═Cu( NO3)2+2H2O;若该步骤只使用20%硝酸,随着反应的进行,温度升高,出现大量红棕色气体,则此时反应为硝酸与过氧化氢反应:2HNO3+H2O2=2NO2↑+2H2O,还原剂为过氧化氢,氧化剂为硝酸,则还原剂与氧化剂的物质的量之比为 1:2;
故答案为:Cu+H2O2+2HNO3═Cu( NO3)2+2H2O; 1:2;
(6)将硝酸铜溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到Cu(NO3)2•3H2O,需要的玻璃仪器有:酒精灯、玻璃棒、烧杯、漏斗;
故答案为:酒精灯、玻璃棒、烧杯、漏斗.
点评 本题考查物质的制备实验及混合物的分离和提纯,为高频考点,把握流程图中每一步发生的反应及操作方法是解本题关键,注意结合题给信息解答,侧重分析与实验能力的考查,题目难度中等.

 如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1.下列叙述错误的是( )
如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1.下列叙述错误的是( )| A. | X和Z氢化物的热稳定性和还原性均依次减弱 | |
| B. | R、W和氢三种元素形成的阴离子有2种以上 | |
| C. | RY2分子中每个原子的最外层均为8电子结构 | |
| D. | R、Y、Z的最高价氧化物对应的水化物的酸性依次增强 |

| A. | 若乙为白色沉淀,则甲中可能含有SiO32- | |
| B. | 若乙为淡黄色沉淀,则甲中可能含有FeBr3 | |
| C. | 若乙为淡黄色沉淀,则甲中可能含有S2- | |
| D. | 若乙为白色沉淀,则甲中一定含有FeCl3 |
| A. | 分散质颗粒直径都在1~100nm之间 | B. | 都能透过半透膜 | ||
| C. | 都是均一、稳定的液体 | D. | 都能产生丁达尔效应 |
| A. | 升高温度,正反应速率增加,逆反应速率减小 | |
| B. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 | |
| C. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
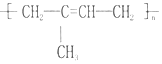 的名称聚2-甲基-1,3-丁二烯,其单体的结构简式CH2═C(CH3)CH═CH2.
的名称聚2-甲基-1,3-丁二烯,其单体的结构简式CH2═C(CH3)CH═CH2.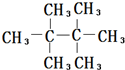 .
. .
.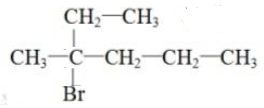 .
.