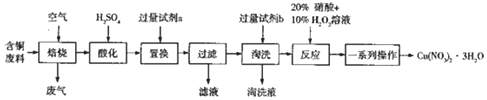
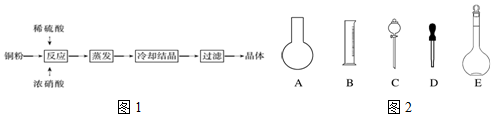
题目内容
19.下列方程式书写正确的有( )①向NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-
②向酸性KMnO4溶液中滴加适量H2C2O4溶液,原溶液紫色褪去:2MnO4-+5H2C2O4═2Mn2++10CO2↑+2H2O+6OH-
③碳酸的电离方程式:H2CO3?2H++CO32-
④NaClO溶液中CIO-的水解:ClO-+H2O═HClO+OH-
⑤酸性条件下,用H2O2将I-氧化为I2:H2O2+2I-+2H+═I2+2H2O
⑥向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①二氧化碳过量,反应生成碳酸氢根离子;
②酸性条件下,反应产物中不能存在氢氧根离子;
③碳酸为二元弱酸,电离方程式分步进行,主要写出第一步电离即可;
④次氯酸根离子的水解为可逆反应,应该用可逆号;
⑤酸性条件下,用H2O2将I-氧化为I2;
⑥反应后溶液呈中性,氢离子与氢氧根离子恰好反应.
解答 解:①向NaAlO2溶液中通入过量的CO2,反应生成氢氧化铝沉淀和碳酸氢根离子,正确的离子方程式为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,故①错误;
②向酸性KMnO4溶液中滴加适量H2C2O4溶液,原溶液紫色褪去,正确的离子方程式为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O,故②错误;
③碳酸的电离分步进行,主要以第一步为主,正确的电离方程式为:H2CO3?H++HCO3-,故③错误;
④NaClO溶液中ClO-的水解为可能反应,应该用可逆号,正确的离子方程式为:ClO-+H2O?HClO+OH-,故④错误;
⑤酸性条件下,用H2O2将I-氧化为I2,反应的离子方程式为:H2O2+2I-+2H+═I2+2H2O,故⑤正确;
⑥向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性,氢离子、氢氧根离子都完全反应,正确的离子方程式为:22H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故⑥错误;
故选A.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
10.下列过程中吸收热量的是( )
| A. | 焦炭制水煤气 | B. | 浓硫酸的稀释 | C. | 酸碱中和反应 | D. | 镁条溶于盐酸 |
7.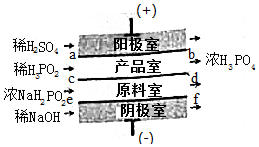 次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )
次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )
 次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )
次磷酸(H3PO2)位一元酸,具有较强的还原性.可利用NaH2PO2为原料,通过四室电渗析法制备,工作原理如图所示,采用惰性电极,ab,cd,ef均为只允许阳离子(或阴离子)通过的离子交换膜,分别称为阳膜(或阴离子),下列说法描述错误的是( )| A. | 阳极室反应为:2H2O-4e-=O2↑+4H+ | |
| B. | ab,ef均为阳膜,cd为阴膜 | |
| C. | 若将稀H2SO4改为H3PO3,撤去ab膜,产品中总混有杂质的原因是:H3PO2在阳极放电而被氧化生成H3PO4 | |
| D. | 通电后产品室中的H+离子向原料室迁移 |
4.25℃时,下列离子组在给定条件下可能大量共存的是( )
| A. | 使甲基橙显红色的溶液中:Fe2+、ClO-、Na+、SO42- | |
| B. | 溶有少量NaOH的溶液中:NH4+、Mg2+、HCO3-、NO3- | |
| C. | 水电离出的c(H+)=1.0×10-12mol•L-1溶液中:K+、Na+、S2-、SO32- | |
| D. | 溶有大量FeCl3的溶液中:NH4+、Na+、CI-、SCN- |
11.有机物甲、乙的结构如图所示,下列说法正确的是( )
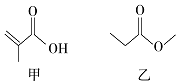
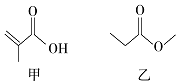
| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成反应 | |
| C. | 与甲具有相同官能团的同分异构体还有2种 | |
| D. | 与乙具有相同官能团的同分异构体还有2种 |
8.4-AFMF是一种探测物质的荧光素,其结构简式如图.下列有关该物质的说法正确的是( )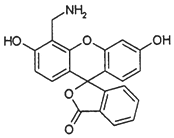

| A. | 分子中三个苯环处于同一平面 | |
| B. | 1 mol 4-AFMF 最多可与2molNaOH 反应 | |
| C. | 在酸性条件下水解,水解产物只有1种 | |
| D. | 能与溴水、FeCl3溶液及稀硫酸发生反应 |
15.工业上通常采用N2(g)和H2(g)崔华成NH3(g):N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为$\frac{1}{12{a}^{2}}$(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3,判断平衡移动的方向是正向移动(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为0mol/L<c(NH3)<0.3mol/L;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为0mol/L≤c(NH3)≤0.3mol/L.
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
则Q1+Q2=92.4kJ;a1+a2=l(填“<”“>”或“=”•下同):2p2>p3
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2,一段时间又达到平衡时,B的体积为1.7L(连通管中气体体积不计).

(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为$\frac{1}{12{a}^{2}}$(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3,判断平衡移动的方向是正向移动(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为0mol/L<c(NH3)<0.3mol/L;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为0mol/L≤c(NH3)≤0.3mol/L.
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
| 平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
| 反应物转化率 | a1 | a2 | a3 | |
| 体系压强(Pa) | p1 | P2 | P3 | |
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2,一段时间又达到平衡时,B的体积为1.7L(连通管中气体体积不计).