题目内容
5.Cu与2mol/L的稀硝酸反应,如果NO3-的浓度下降0.3mol/L,则同时溶液中H+浓度下降( )| A. | 0.3 mol/L | B. | 0.6mol/L | C. | 0.9 mol/L | D. | 1.2mol/L |
分析 设参加反应的H+物质的量为x,依据化学方程式定量关系计算,减少的硝酸根离子和生成的一氧化氮物质的量相同,结合化学方程式定量关系计算得到;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,据关系式3Cu-----8H+-----2NO-----2NO3-(减少的)
解答 解:Cu与2mol/L的稀硝酸反应,如果NO3-的浓度下降0.3mol/L,则同时溶液中H+浓度下降可以依据溶液反应实质计算,
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
据关系式3Cu-----8H+-----2NO-----2NO3-(减少的)
8 2
x 0.3mol/L
x=1.2mol/L,
故选D.
点评 本题考查了化学方程式计算分析应用,注意反应过程分析判断,硝酸根离子减小量使做氧化剂的硝酸的量,掌握基础是关键,题目较简单.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
3.(1)已知在常温下测得浓度均为0.1mol•L-1的5种溶液的pH:
①上述溶液中的阴离子CH3COO-、HCO3-、CO32-、ClO-、CN-,结合H+能力最强的是CO32-.(用离子符号表示)
②根据表中数据,常温下,浓度均为0.1mol•L-1的下列4种物质的溶液中,pH最小的是B(填字母,下同);将各溶液分别稀释100倍,pH变化最小的是A
A.HCN B.CH3COOH c.H2CO3 d.HClO
(2)现有常温下的6份溶液:
a.0.01mol•L-1的CH3COOH溶液;b.0.01mol•L-1HCl溶液;c.pH=13的氨水;d.pH=13的NaOH溶液;e.0.01mol•L-1的CH3COOH溶液与pH=12的NaOH溶液等体积混合后所得溶液;f.0.01mol•L-1的HCl溶液与pH=12的NaOH溶液等体积混合后所得溶液.
①其中水的电离程度最大的是e(填字母,下同),水的电离程度相同的是cd;
②将b、d混合后所得溶液pH=12,则消耗b、d溶液的体积之比为9:2;
③将溶液同等稀释10倍后溶液的pH:c>d,e>f(选填“>”、“<”或“=”)
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
②根据表中数据,常温下,浓度均为0.1mol•L-1的下列4种物质的溶液中,pH最小的是B(填字母,下同);将各溶液分别稀释100倍,pH变化最小的是A
A.HCN B.CH3COOH c.H2CO3 d.HClO
(2)现有常温下的6份溶液:
a.0.01mol•L-1的CH3COOH溶液;b.0.01mol•L-1HCl溶液;c.pH=13的氨水;d.pH=13的NaOH溶液;e.0.01mol•L-1的CH3COOH溶液与pH=12的NaOH溶液等体积混合后所得溶液;f.0.01mol•L-1的HCl溶液与pH=12的NaOH溶液等体积混合后所得溶液.
①其中水的电离程度最大的是e(填字母,下同),水的电离程度相同的是cd;
②将b、d混合后所得溶液pH=12,则消耗b、d溶液的体积之比为9:2;
③将溶液同等稀释10倍后溶液的pH:c>d,e>f(选填“>”、“<”或“=”)
13.实验室要配制100mL 0.1mol•L-1 Na2CO3溶液,下列说法正确的是( )
| A. | 称取1.06g无水Na2CO3,加入100mL容量瓶中溶解,定容 | |
| B. | 需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管 | |
| C. | 定容时俯视容量瓶刻度线,浓度偏高 | |
| D. | 取所配溶液10 mL,所取溶液中Na+浓度为0.1 mol•L-1 |
20.下列离子方程式书写正确的是( )
| A. | 向硫酸酸化的FeSO4溶液中加入过量的H2O2溶液:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸镁与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
14.能导电的电解质是( )
| A. | 氯化钠溶液 | B. | 金属铜 | C. | 熔融硝酸钾 | D. | 酒精 |
 合成氨的流程示意图如图:回答下列问题:
合成氨的流程示意图如图:回答下列问题: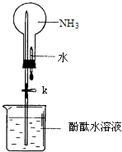 某学习小组欲制取氨气并探究其性质.请回答:
某学习小组欲制取氨气并探究其性质.请回答: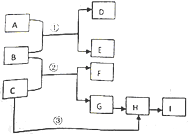 下列框图中物质均为中学化学常见物质.已知A、B、C均为有刺激性气味气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体,反应②有大量白烟生成.
下列框图中物质均为中学化学常见物质.已知A、B、C均为有刺激性气味气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体,反应②有大量白烟生成.