题目内容
7.下列实验中,不能观察到明显变化的是( )| A. | 金属钾投入水中 | B. | 镁条放入冷水中 | ||
| C. | KSCN溶液滴加到FeCl3溶液中 | D. | 氯水滴加到KI淀粉溶液中 |
分析 A.钾性质活泼,与水剧烈反应;
B.镁与冷水不反应;
C.FeCl3与KSCN反应溶液变红色;
D.氯水具有氧化性,可将KI氧化物I2.
解答 解:A.钾性质活泼,与水剧烈反应,放出大量的热并有气泡生成,现象明显且剧烈,故A不选;
B.镁与冷水不反应,可与热水发生反应,把一段打磨过的镁带放入少量冷水中,不能观察到明显变化,故B选;
C.KSCN溶液滴加到FeCl3溶液中,FeCl3与KSCN反应溶液变红色,故C不选;
D.氯水具有氧化性,可将KI氧化物I2,I2遇淀粉溶液变蓝色,故D不选.
故选B.
点评 本题考查元素化合物的性质,题目难度不大,注意常见元素化合物的性质,侧重于基础知识的考查.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
17.某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于如表:
①可以判断该分解反应已经达到平衡的是BC.
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8(mol•L-1)3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
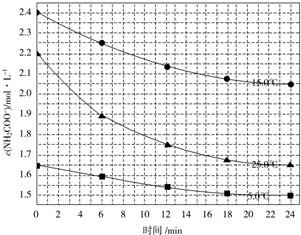
⑤计算25.0℃时,0~6min氨基甲酸铵水解反应的平均速率:0.05mol/(L•min).
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于如表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓 度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8(mol•L-1)3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.

⑤计算25.0℃时,0~6min氨基甲酸铵水解反应的平均速率:0.05mol/(L•min).
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
18.Ni(s)+4CO(g)?Ni(CO)4(g)在一密闭容器中,放入棉粉并充入一定量的CO气体,已知该反应平衡常数与温度的关系下表:下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时反应逆向进行 | |
| C. | 25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 | |
| D. | 恒温恒容,向已达平衡的容器中再充入少量Ni(CO)4(g),达到新平衡时,CO的体积百分含量将减小 |
2.下列各组化合物中,化学键类型完全相同的是( )
| A. | Na2O2 和Na2O | B. | MgCl2 和Na2S | C. | CaO和CO2 | D. | HCl 和NaOH |
12.聚异丁烯( )是生产汽油清洁剂的中间产物.下列关于聚异丁烯的说法中错误的是( )
)是生产汽油清洁剂的中间产物.下列关于聚异丁烯的说法中错误的是( )
 )是生产汽油清洁剂的中间产物.下列关于聚异丁烯的说法中错误的是( )
)是生产汽油清洁剂的中间产物.下列关于聚异丁烯的说法中错误的是( )| A. | 聚异丁烯可以通过加聚反应制得 | |
| B. | 聚异丁烯的分子式为(C4H8)n | |
| C. | 聚异丁烯能使溴的四氯化碳溶液褪色 | |
| D. | 聚异丁烯完全燃烧生成CO2 和H2O的物质的量相等 |
19.化学在生产和生活中有着重要的应用.下列说法不正确的是( )
| A. | 炼铁时增大高炉的高度,能有效减少CO的排放 | |
| B. | 明矾在水处理中可作净水剂 | |
| C. | 热电厂进行燃煤时将煤块压碎以提高煤的燃烧效率 | |
| D. | 在海轮外壳上镶嵌锌块,能减缓船体的腐蚀速率 |
16.有两份组成及质量都相等的Na2O2和Na2CO3的混合物,向第一份中加入足量的稀硫酸,放出的气体共4.48L.将此气体通入第二份混合物,充分反应后,气体体积变为4.032L(均为标准状况下体积).则原混合物中Na2O2和Na2CO3的物质的量之比为( )
| A. | 2:9 | B. | 3:2 | C. | 2:1 | D. | 8:1 |
17.下列物质常用于工业生产制冷剂的是( )
| A. | 液氨 | B. | 液氧 | C. | 液氯 | D. | 液氢 |
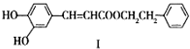 不饱和酯类化合物在药物、涂料等方面应用广泛.
不饱和酯类化合物在药物、涂料等方面应用广泛. .
.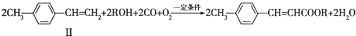
 (写1种);由Ⅳ生成Ⅱ的反应条件为氢氧化钠的醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为氢氧化钠的醇溶液、加热.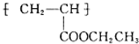 可用于制备涂料.其单体的结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机原料合成该单体,涉及的反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件}{→}$2CH2=CHCOOCH2CH3+2H2O.
可用于制备涂料.其单体的结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机原料合成该单体,涉及的反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件}{→}$2CH2=CHCOOCH2CH3+2H2O.