题目内容
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):

请回答下列问题:
(1)A物质的化学名称是 ;
(2)写出A在铜作催化剂条件下与O2加热的反应方程式 .
(3)写出C在一定条件下反应生成A和B的反应方程式 ,该反应的类型为 .
(4)聚乙烯的单体为 ,链节为 .

请回答下列问题:
(1)A物质的化学名称是
(2)写出A在铜作催化剂条件下与O2加热的反应方程式
(3)写出C在一定条件下反应生成A和B的反应方程式
(4)聚乙烯的单体为
考点:乙烯的化学性质,有机物的结构和性质
专题:有机反应
分析:乙烯与水加成生成A,A为乙醇,乙醇催化氧化生成B,B为乙酸,乙酸与乙醇反应生成C,C为乙酸乙酯,据此解答.
解答:
解:乙烯与水加成生成A,A为乙醇,乙醇催化氧化生成B,B为乙酸,乙酸与乙醇反应生成C,C为乙酸乙酯,
(1)由上述分析可知,A是乙醇,故答案为:乙醇;
(2)乙醇中含-OH,能发生催化氧化生成乙醛,该反应方程式为:2CH3CH2OH+O2
2CH3CHO+2H2O;
故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;
(3)乙酸乙酯在酸性条件下水解生成乙酸与乙醇,反应方程式为:CH3COOCH2CH3+H2O
CH3CH2OH+CH3COOH;
故答案为:CH3COOCH2CH3+H2O
CH3CH2OH+CH3COOH;取代反应;
(3)乙烯通过加聚反应生成聚乙烯,乙烯为聚乙烯的单体,-CH2-CH2-为链节;
故答案为:乙烯;-CH2-CH2-;
(1)由上述分析可知,A是乙醇,故答案为:乙醇;
(2)乙醇中含-OH,能发生催化氧化生成乙醛,该反应方程式为:2CH3CH2OH+O2
| 铜或银 |
| △ |
故答案为:2CH3CH2OH+O2
| 铜或银 |
| △ |
(3)乙酸乙酯在酸性条件下水解生成乙酸与乙醇,反应方程式为:CH3COOCH2CH3+H2O
| 一定条件 |
故答案为:CH3COOCH2CH3+H2O
| 一定条件 |
(3)乙烯通过加聚反应生成聚乙烯,乙烯为聚乙烯的单体,-CH2-CH2-为链节;
故答案为:乙烯;-CH2-CH2-;
点评:本题考查有机推断,涉及烯烃、醇、醛、羧酸等性质以及学生推理能力等,是对有机化合物知识的综合考查,能较好的考查考生的思维能力,难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
已知常温下CH3COOH和NH3?H2O的电离常数相等,向10mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
| A、水的电离程度始终增大 | ||
B、
| ||
| C、c(CH3COOH)与c(CH3COO-)之和始终保持不变 | ||
| D、当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-) |
下列相应说法正确的是( )
| A、将城市的大型电镀工厂改建在农村,既促进农村经济发展又减轻城市用水污染 | ||||
| B、可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大 | ||||
| C、核裂变是一种化学变化 | ||||
D、核电站泄露的
|
下列实验过程中,始终无明显现象的是( )
| A、CO2通入CaCl2溶液中 |
| B、NO2通入FeSO4溶液中 |
| C、NH3通入AlCl3溶液中 |
| D、SO2通入已酸化的Ba(NO3)2溶液中 |
常温下,0.1mol?L-1CH3COONa溶液pH=11,下列表述正确的是( )
| A、c(Na+)=c(CH3COO-) |
| B、c(CH3COO-)+c(CH3COOH)=0.1 mol?L-1 |
| C、由水电离出来的c(OH-)=1.0×10-11 mol?L-1 |
| D、往该溶液中加入等体积的水,pH值变大 |
下列实验操作中所用仪器合理的是( )
| A、用10mL量筒量取 5.2mL 盐酸 |
| B、用100mL量筒量取 5.2mL 盐酸 |
| C、用托盘天平称取25.02g NaCl |
| D、用100 mL 容量瓶配制 50 mL 0.1 mol/L 的盐酸 |
用下列实验装置或操作进行相应实验,能达到实验目的是( )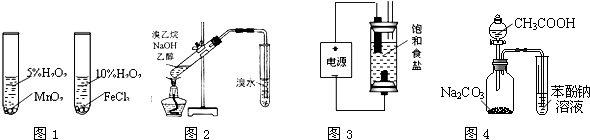

| A、用图1装置验证比较不同催化剂对反应速率的影响 |
| B、用图2所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯 |
| C、用图3装置制备少量含NaClO的消毒液 |
| D、利用图4装置证明酸性:CH3COOH>H2CO3>苯酚 |

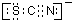 ,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;
,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;