题目内容
在解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )
| A、HF、HCl、HBr、HI的热稳定性依次减弱 |
| B、NaF、NaCl、NaBr、NaI的熔点依次降低 |
| C、F2、Cl2、Br2、I2的熔沸点逐渐升高 |
| D、H2S的熔沸点小于H2O的熔沸点 |
考点:键能、键长、键角及其应用
专题:化学反应中的能量变化
分析:A.元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定;
B.结构相似的离子晶体,离子半径越小,晶格能越大;
C.F2、C12、Br2、I2属于分子晶体,影响熔沸点高低的因素是分子间作用力的大小,与化学键能无关;
D.H2O含有氢键,熔沸点较高.
B.结构相似的离子晶体,离子半径越小,晶格能越大;
C.F2、C12、Br2、I2属于分子晶体,影响熔沸点高低的因素是分子间作用力的大小,与化学键能无关;
D.H2O含有氢键,熔沸点较高.
解答:
解:A.非金属性F>Cl>Br>I,元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定,故A不选;
B.NaF、NaCl、NaBr、NaI都为离子晶体,离子半径越小,晶格能越大,故B不选;
C.F2、C12、Br2、I2属于分子晶体,影响熔沸点高低的因素是分子间作用力的大小,与化学键能无关,故C选;
D.H2O含有氢键,熔沸点较高,与键能无关,故D选.
故选CD.
B.NaF、NaCl、NaBr、NaI都为离子晶体,离子半径越小,晶格能越大,故B不选;
C.F2、C12、Br2、I2属于分子晶体,影响熔沸点高低的因素是分子间作用力的大小,与化学键能无关,故C选;
D.H2O含有氢键,熔沸点较高,与键能无关,故D选.
故选CD.
点评:本题考查键能的大小比较及元素周期律的递变规律,题目难度不大,注意把握晶体类型的判断以及影响晶体熔沸点高低的因素.

练习册系列答案
相关题目
根据中央气象台报道,近年每到秋末冬初季节,西安市多次出现大雾天气,致使高速公路关闭,航班停飞.雾属于下列分散系中的( )
| A、溶液 | B、悬浊液 |
| C、胶体 | D、乳浊液 |
下列说法中正确的是( )
| A、二氧化碳的水溶液能导电,所以二氧化碳是电解质 |
| B、1mol?L-1的硫酸钠溶液和1mol?L-1的氢氧化钠溶液,分别做导电性实验,两种溶液的导电性不同 |
| C、氢氧化铁胶体能导电,故氢氧化铁胶体是电解质 |
| D、在相同温度下,饱和溶液一定比不饱和溶液的导电性强 |
能正确表示下列反应的离子方程式的是( )
| A、将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B、CuSO4溶液中加入少量Ba(OH)2溶液:SO42-+Ba2+=BaSO4 |
| C、将Cu丝插入AgNO3溶液中:Cu+Ag+=Cu2++Ag |
| D、用小苏打NaHCO3治疗胃酸过多:HCO3-+H+=H2O+CO2↑ |

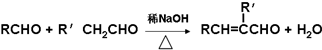
 ”结构的共有
”结构的共有
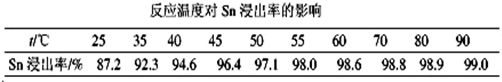
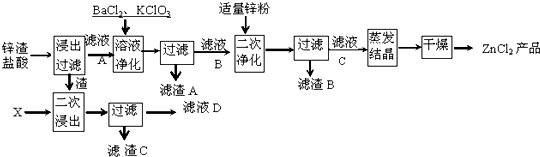
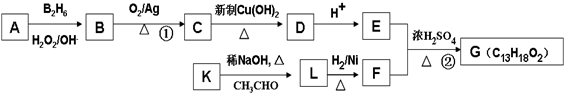
 如图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物.
如图中 A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物.