题目内容
现有稀盐酸、稀硫酸、氢氧化钡、碳酸钠四瓶失去标签的溶液,分别编号为A、B、C、D,每次取少量溶液两两混合,所观察到的现象记录在下表中(”-”表示无明显现象;”↓”表示有沉淀生成;”↑”表示有气体生成):
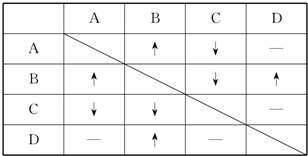
(1)由表知A为 ,B为 ,C为 ,D为 (填化学式).
(2)写出上述实验过程中有关物质间反应的离子方程式.
A+B: .B+C: .A+C: .

(1)由表知A为
(2)写出上述实验过程中有关物质间反应的离子方程式.
A+B:
考点:无机物的推断,物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:将所给四种物质两两混合,产生一个气体的是盐酸,一个沉淀一个气体的是硫酸,两个沉淀的是氢氧化钡,两个气体一个沉淀的是碳酸钠,A是一个气体一个沉淀,故A为硫酸;B是两个气体一个沉淀,故B为碳酸钠;C是两个沉淀,C为氢氧化钡;D是一个气体,D为盐酸,以此来解答.
解答:
解:(1)根据现象记录表,四种溶液两两混合时,A溶液出现沉淀、放出气体、无明显现象各一次,符合稀硫酸与其它溶液混合所出现的现象,判断A为硫酸;B溶液出现一次沉淀、两次放出气体,和碳酸钠与其它溶液混合的现象相符,判断B为碳酸钠;C溶液出现两次沉淀、一次无明显现象,符合氢氧化钡与其它溶液混合时的现象,判断C为氢氧化钡;D溶液只出现一次放出气体、其余二次均为无明显现象,正是稀盐酸与其它溶液混合的现象,判断D为稀盐酸;
故答案为:H2SO4;Na2CO3;Ba(OH)2;HCl;
(2)A+B为硫酸与碳酸钠反应,离子方程式为CO32-+2H+=CO2↑+H2O;
B+C为氢氧化钡与碳酸钠反应,离子方程式为CO32-+Ba2+=BaCO3↓;
A+C为硫酸与氢氧化钡反应,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,
故答案为:CO32-+2H+=CO2↑+H2O;CO32-+Ba2+=BaCO3↓;Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
故答案为:H2SO4;Na2CO3;Ba(OH)2;HCl;
(2)A+B为硫酸与碳酸钠反应,离子方程式为CO32-+2H+=CO2↑+H2O;
B+C为氢氧化钡与碳酸钠反应,离子方程式为CO32-+Ba2+=BaCO3↓;
A+C为硫酸与氢氧化钡反应,离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,
故答案为:CO32-+2H+=CO2↑+H2O;CO32-+Ba2+=BaCO3↓;Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
点评:本题考查无机物的推断,为高频考点,把握物质之间的反应及现象为解答的关键,侧重分析、推断及实验能力的综合考查,注意实验现象的综合应用,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
在强酸性溶液中可以大量共存的离子组是( )
| A、K+、NO3ˉ、Fe2+、Clˉ |
| B、SO42-、Mg2+、Clˉ、Na+ |
| C、SO42-、Na+、Mg2+、CH3COOˉ |
| D、Clˉ、SCNˉ、K+、Fe3+ |
下列各组内物质不论以任何比例混合,只要当混合物的质量一定时,混合物完全燃烧后生成的二氧化碳量不变的是( )
| A、甲苯和乙苯 | B、乙烯和丙烯 |
| C、乙烷和乙烯 | D、乙烯和苯 |
用下列装置进行相应实验,能达到实验目的是( )
A、 用图能证明酸性:硫酸>碳酸>次氯酸 |
B、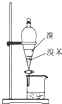 用图所示装置分离出溴苯 |
C、 用图设计成铜锌原电池装置 |
D、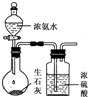 用图制取干燥的氨气 |
下列仪器:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥烧杯 ⑦试管,常用于物质分离的是( )
| A、①③④ | B、①②⑥ |
| C、①③⑤ | D、③④⑦ |
二氯化二硫(S2Cl2)可用作橡胶工业的硫化剂,常温下它是橙黄色有恶臭的液体,它的分子结构与H2O2相似,熔点为193K,沸点为411K,遇水很容易反应,产生的气体能使品红褪色,S2Cl2可由干燥的氯气通入熔融的硫中制得.下列有关说法不正确的是( )
| A、S2Cl2分子中各原子均达到8电子稳定结构 |
| B、制备S2Cl2的反应是化合反应,不是氧化还原反应 |
| C、S2Cl2遇水反应的化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl |
| D、S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 |
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g),所得实验数据如下表:下列说法正确的是( )
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A、实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol?L-1?min-1 |
| B、实验②中,该反应的平衡常数K=2.0 |
| C、实验③中,达到平衡时,X的转化率为40% |
| D、实验④中,达到平衡时,b<0.060 |